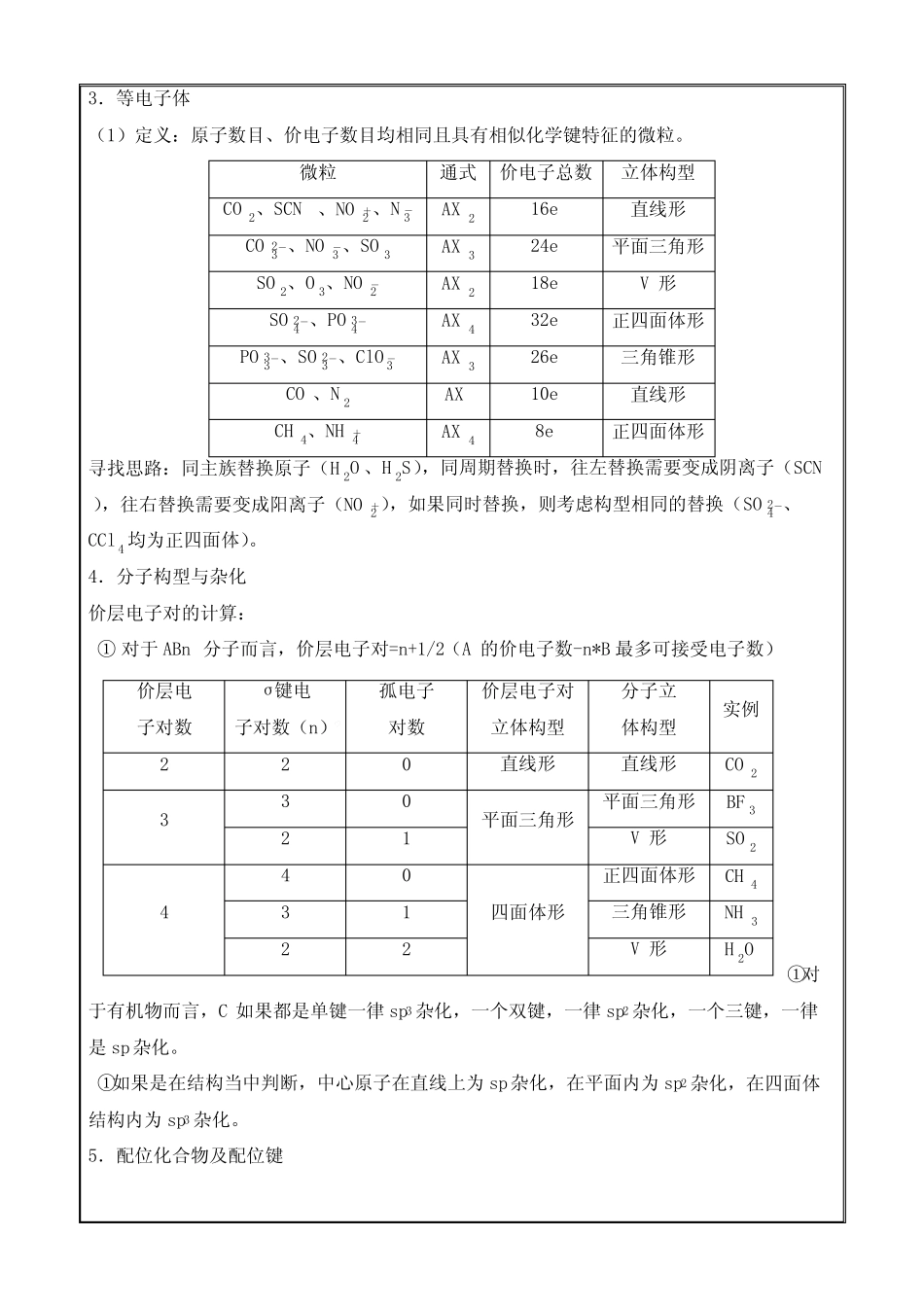
物质结构与性质综合题一、原子结构与性质1.常考电子表达表示方法含义举例原子或离子结构示意图表示核外电子分层排布和核内质子数Na:Na+:电子式表示原子最外层电子数目核外电子排布式表示每个能级上排布的电子数S:1s22s22p63s23p4或[Ne]3s23p4S2−:1s22s22p63s23p6电子排布图(轨道表示式)表示每个原子轨道中电子的运动状态价电子排布式或排布图表示价电子的排布价电子定义:非主族元素,价电子等同于最外层电子,过渡元素,价电子为3d4s上的电子。二、分子结构与性质1.化学键类型单键为σ,双键为σ+π,三键为σ+2π。不同原子之间成键为极性键、相同原子之间成键为非极性键。直线型的AB2、平面型的AB3、AB4均为非极性分子,其余的为极性分子。2.键参数(1)键能:气体基态原子形成1mol化学键所释放的最小能量(2)键长:两个原子核的核间距离(半径越大,键长越长)(3)键角:①首先判断中心原子杂化方式,sp>sp2>sp3;①如果中心原子杂化方式相同时,看孤对电子对数目,数目越多,键角越小;①如果两者均相同,看中心原子电子云密度,密度越大,键角越大。3.等电子体(1)定义:原子数目、价电子数目均相同且具有相似化学键特征的微粒。微粒通式价电子总数立体构型CO2、SCN−、NO+2、N-3AX216e−直线形CO2-3、NO-3、SO3AX324e−平面三角形SO2、O3、NO-2AX218e−V形SO2-4、PO3-4AX432e−正四面体形PO3-3、SO2-3、ClO-3AX326e−三角锥形CO、N2AX10e−直线形CH4、NH+4AX48e−正四面体形寻找思路:同主族替换原子(H2O、H2S),同周期替换时,往左替换需要变成阴离子(SCN−),往右替换需要变成阳离子(NO+2),如果同时替换,则考虑构型相同的替换(SO2-4、CCl4均为正四面体)。4.分子构型与杂化价层电子对的计算:①对于ABn分子而言,价层电子对=n+1/2(A的价电子数-n*B最多可接受电子数)①对于有机物而言,C如果都是单键一律sp3杂化,一个双键,一律sp2杂化,一个三键,一律是sp杂化。①如果是在结构当中判断,中心原子在直线上为sp杂化,在平面内为sp2杂化,在四面体结构内为sp3杂化。5.配位化合物及配位键价层电子对数σ键电子对数(n)孤电子对数价层电子对立体构型分子立体构型实例220直线形直线形CO2330平面三角形平面三角形BF321V形SO2440四面体形正四面体形CH431三角锥形NH322V形H2O(1)配位键是特殊的共价键,因此在计算σ时,也要考虑配位键。(2)并不是每个配合物都会有内外界之分,像Fe(CO)5这类的就没有外界。(3)如何快速判断中心离子/原子?如何判断配位原子?如何判断配位数?金属元素就是中心离子/原子;有孤对电子/都含有的时候,一般电负性小的作为配位原子;内界中除了中心原子/离子以外,其余的离子或者分子均为配体,其个数就是配位数。(4)配体稳定性判断/加热多种配体的失去顺序:配位原子电负性大不稳定/优先失去。(5)通过滴定法确定内外界。根据内界离子不参与反应原则,当内外界有相同离子时,往往加入些可以与之反应的物质,使其产生沉淀,根据沉淀量来推导外界离子数目。三、晶体结构与性质1.如何区分晶体与非晶体间接法:测定是否有固定熔沸点;科学法:对固体进行X-射线衍射实验。2.晶体类型判断(1)分子晶体:常见特征字眼,层状、常温液态,熔沸点低。类别:大多数非金属单质、气态氢化物、酸、非金属氧化物(SiO2除外)、绝大多数有机物(有机盐除外)、Fe(CO)5、Ni(CO)4、FeCl3、AlCl3、BeCl2、可燃冰。作用力:先判断氢键(个数-种类)、再判断范德华力(M-极性)。(2)离子晶体:类别:金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl)作用力:晶格能(离子半径与电荷量)特别提醒:因为晶格能大小受两个因素影响,但有的时候其中一个因素是导致熔沸点上升,另外一个因素是导致熔沸点下降,分析问题应该选择一个与结果一致的因素进行解释。(3)原子晶体:常见特征字眼:立体网状、耐高温、耐磨,熔沸点极高。类别:C、N、O与B、Al、Si两两组合均为原子晶体,还有常规的,金刚石、晶体硅。作用力:共价键(原子半径)。(4)金属晶体:类别:金属单质与合金(如Na、Al、Fe、青...