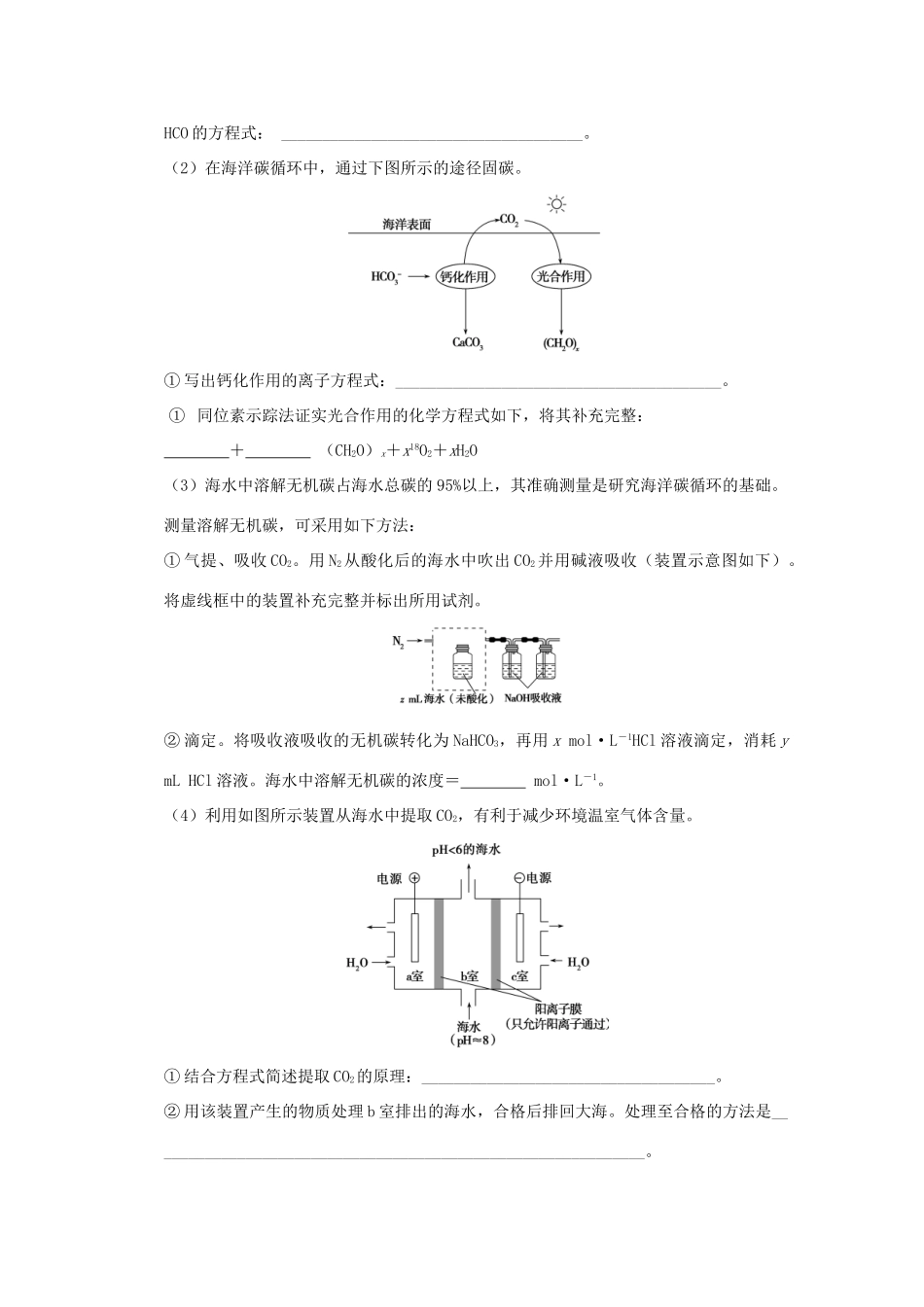
专题十四碳、硅及其化合物无机非金属材料考点一碳及其化合物1.(2014·课标全国卷Ⅱ,7,6分)下列过程没有发生化学反应的是()A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的油污C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装解析A项,用活性炭去除冰箱中的异味利用了吸附原理,没有发生化学反应;B项,热碱水使得油脂发生水解反应而变得易清除;C项,KMnO4能吸收成熟水果释放的乙烯,从而起到保鲜水果的目的;D项,硅胶起干燥作用,而铁粉是脱氧剂,会与O2发生化学反应。答案A2.(2013·江苏化学,6,2分)甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲――→乙丙。下列物质的推断不正确的是()A.若甲为焦炭,则丁可能是O2B.若甲为SO2,则丁可能是氨水C.若甲为Fe,则丁可能是盐酸D.若甲为NaOH溶液,则丁可能是CO2解析A项,,A正确;B项,SO2――→NH4HSO3(NH4)2SO3,B项正确;C项,Fe――→FeCl2,但FeCl2与HCl不反应,C项错误;D项,NaOH――→Na2CO3NaHCO3,D项正确。答案C3.(2015·北京理综,27,14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO占95%。写出CO2溶于水产生HCO的方程式:_____________________________________。(2)在海洋碳循环中,通过下图所示的途径固碳。①写出钙化作用的离子方程式:________________________________________。①同位素示踪法证实光合作用的化学方程式如下,将其补充完整:+(CH2O)x+x18O2+xH2O(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用xmol·L-1HCl溶液滴定,消耗ymLHCl溶液。海水中溶解无机碳的浓度=mol·L-1。(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。①结合方程式简述提取CO2的原理:____________________________________。②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_____________________________________________________________。解析(1)CO2溶于水生成H2CO3,H2CO3电离出H+和HCO。(2)①根据钙化作用的反应物是HCO和Ca2+,生成物是CaCO3和CO2,故不难写出反应的离子方程式为2HCO+Ca2+===CaCO3↓+CO2↑+H2O。②根据元素守恒及示踪原子的标记知,方程式中的填空为:xCO2和2xHO。(3)①该装置为洗气瓶的装置,要注意装置中长管进、短管出,且用分液漏斗滴加酸化所用试剂稀硫酸,因HCl易挥发出来影响后续的滴定而不能用盐酸。②根据该滴定过程得关系式:CO2~HCO~HCl,n(CO2)=n(HCl)=xmol·L-1×y×10-3L=xy×10-3mol,所以c(CO2)==mol·L-1。(4)①a室的电极连接电源的正极,作阳极,发生氧化反应:2H2O―4e-===O2↑+4H+,c(H+)增大,H+从a室通过阳离子交换膜进入b室,发生反应:HCO+H+===CO2↑+H2O。②海水的pH≈8,电解后的海水pH<6,呈酸性;c室的反应:2H2O+2e-===H2↑+2OH-,可用c室排出的碱液与从b室排出的酸液中和调至接近装置入口海水的pH,即处理合格。答案(1)CO2+H2O===H2CO3、H2CO3H++HCO(2)①2HCO+Ca2+===CaCO3↓+CO2↑+H2O②xCO22xHO(3)①②(4)①a室:2H2O―4e-===O2↑+4H+,H+通过阳离子膜进入b室,发生反应:HCO+H+===CO2↑+H2O②c室的反应:2H2O+2e-===H2↑+2OH-,用c室排出的碱液将从b室排出的酸液调至接近装置入口海水的pH4.(2014·课标全国卷Ⅱ,27,15分)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第周期、第族;PbO2的酸性比CO2的酸性(填“强”或“弱”)。(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为____________________...