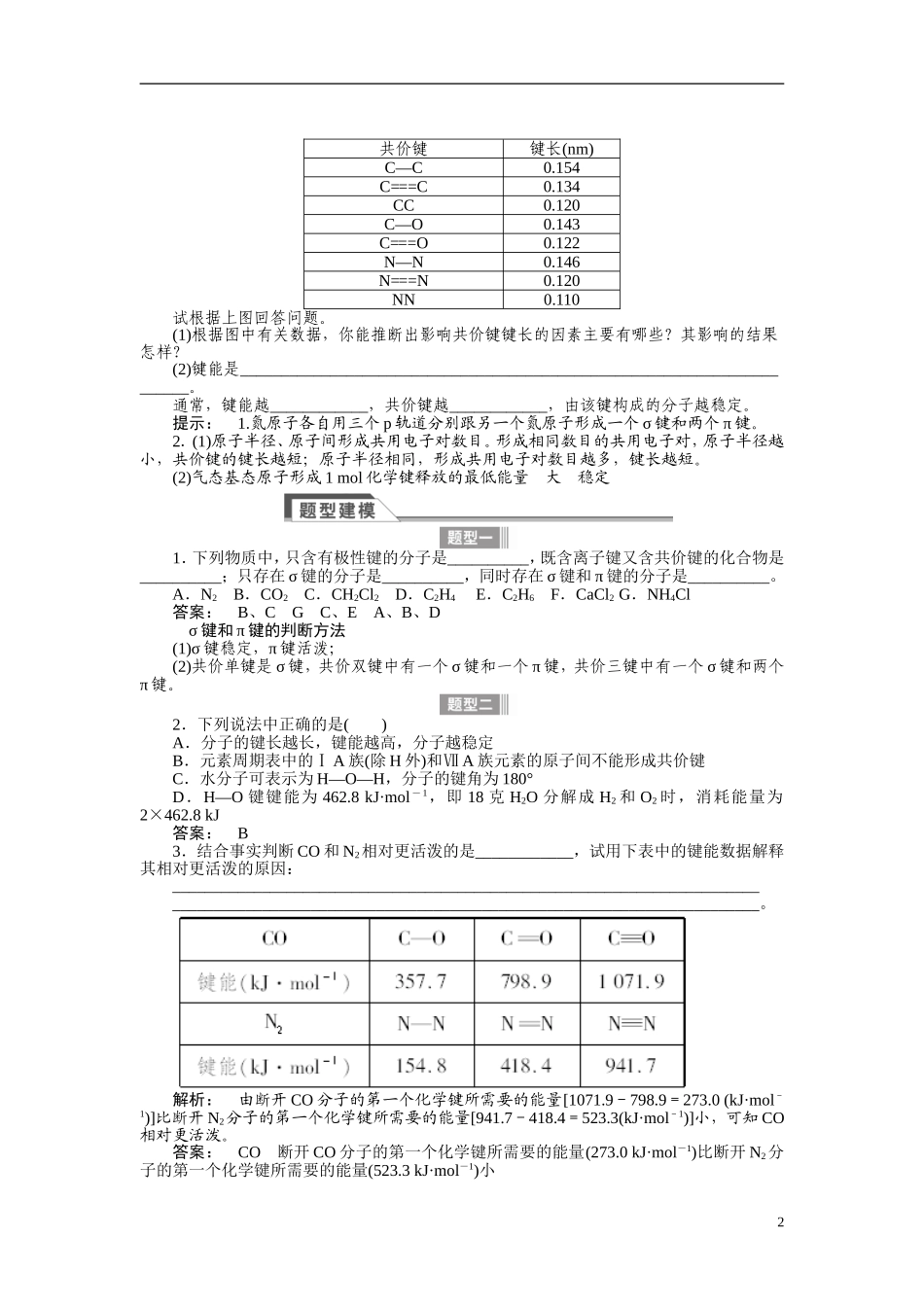
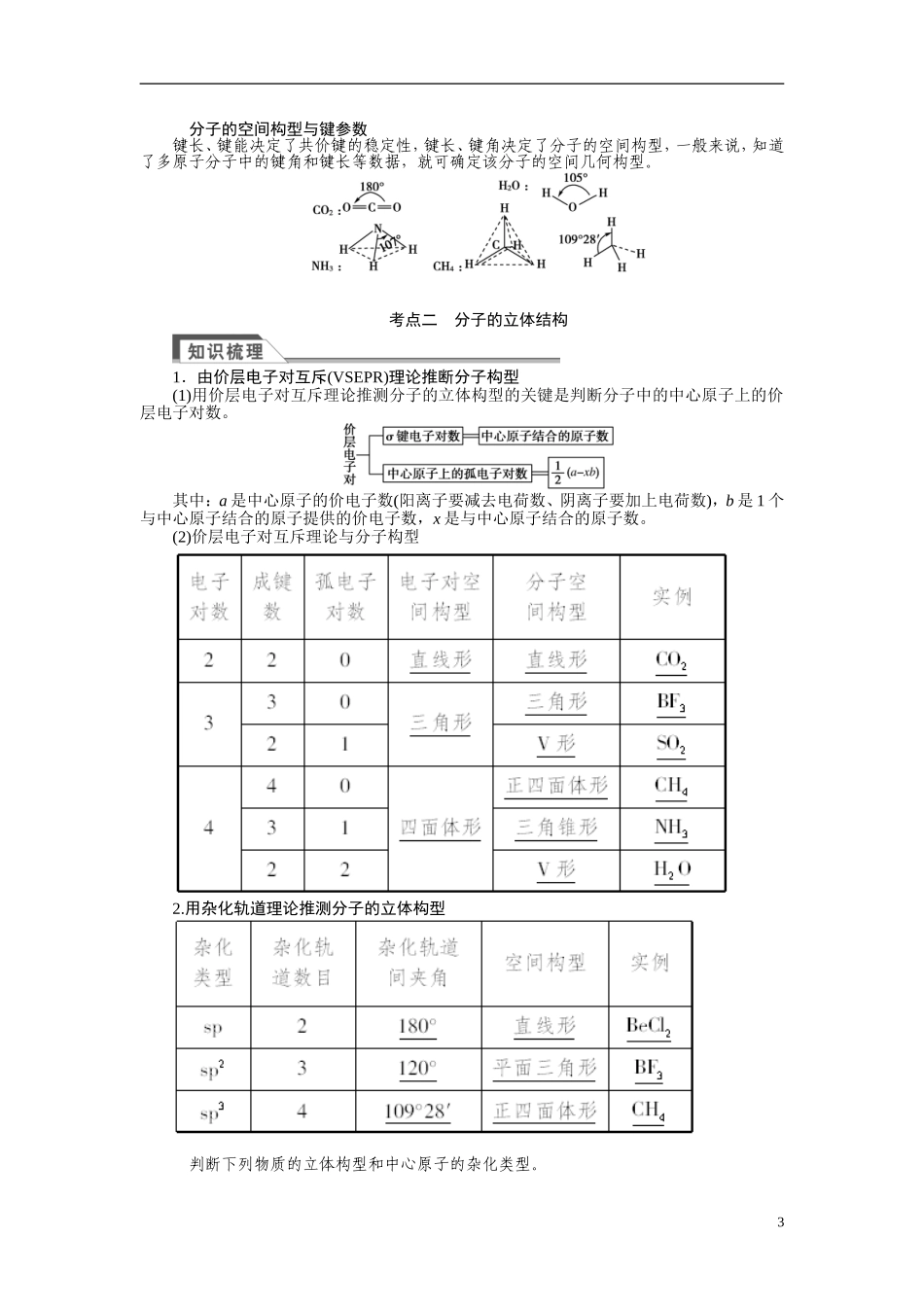
2015《金版新学案》高中化学总复习讲义:选修3第二单元分子结构与物质性质考点一共价键1.本质:在原子之间形成共用电子对。2.特征:具有饱和性和方向性。3.分类4.键参数(1)键参数对分子性质的影响(2)键参数与分子稳定性的关系键能越大,键长越短,分子越稳定。1.根据价键理论分析氮气分子中的成键情况。2.某些共价键的键长数据如下图所示:1共价键键长(nm)C—C0.154C===C0.134CC0.120C—O0.143C===O0.122N—N0.146N===N0.120NN0.110试根据上图回答问题。(1)根据图中有关数据,你能推断出影响共价键键长的因素主要有哪些?其影响的结果怎样?(2)键能是________________________________________________________________________。通常,键能越____________,共价键越____________,由该键构成的分子越稳定。提示:1.氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键。2.(1)原子半径、原子间形成共用电子对数目。形成相同数目的共用电子对,原子半径越小,共价键的键长越短;原子半径相同,形成共用电子对数目越多,键长越短。(2)气态基态原子形成1mol化学键释放的最低能量大稳定1.下列物质中,只含有极性键的分子是__________,既含离子键又含共价键的化合物是__________;只存在σ键的分子是__________,同时存在σ键和π键的分子是__________。A.N2B.CO2C.CH2Cl2D.C2H4E.C2H6F.CaCl2G.NH4Cl答案:B、CGC、EA、B、Dσ键和π键的判断方法(1)σ键稳定,π键活泼;(2)共价单键是σ键,共价双键中有一个σ键和一个π键,共价三键中有一个σ键和两个π键。2.下列说法中正确的是()A.分子的键长越长,键能越高,分子越稳定B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键C.水分子可表示为H—O—H,分子的键角为180°D.H—O键键能为462.8kJ·mol-1,即18克H2O分解成H2和O2时,消耗能量为2×462.8kJ答案:B3.结合事实判断CO和N2相对更活泼的是____________,试用下表中的键能数据解释其相对更活泼的原因:________________________________________________________________________________________________________________________________________________。解析:由断开CO分子的第一个化学键所需要的能量[1071.9-798.9=273.0(kJ·mol-1)]比断开N2分子的第一个化学键所需要的能量[941.7-418.4=523.3(kJ·mol-1)]小,可知CO相对更活泼。答案:CO断开CO分子的第一个化学键所需要的能量(273.0kJ·mol-1)比断开N2分子的第一个化学键所需要的能量(523.3kJ·mol-1)小2分子的空间构型与键参数键长、键能决定了共价键的稳定性,键长、键角决定了分子的空间构型,一般来说,知道了多原子分子中的键角和键长等数据,就可确定该分子的空间几何构型。考点二分子的立体结构1.由价层电子对互斥(VSEPR)理论推断分子构型(1)用价层电子对互斥理论推测分子的立体构型的关键是判断分子中的中心原子上的价层电子对数。其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b是1个与中心原子结合的原子提供的价电子数,x是与中心原子结合的原子数。(2)价层电子对互斥理论与分子构型2.用杂化轨道理论推测分子的立体构型判断下列物质的立体构型和中心原子的杂化类型。3BF3________;PF3________;SO3________;SO2________;H2S________。提示:B最外层有3个电子,与3个F原子形成3个σ键,是sp2杂化,平面三角形;P最外层有5个电子,与3个F原子形成3个σ键后余下的孤电子对数为1,是sp3杂化,三角锥形;SO3:孤电子对数为=0,σ键个数为3,所以是sp2杂化,平面三角形;SO2:孤电子对数为=1,σ键个数为2,所以sp2杂化,V形;H2S:孤电子对数为=2,σ键个数为2,所以是sp3杂化,V形。1.在乙烯分子中有5个σ键和1个π键,它们分别是()A.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C.C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键D.C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键解析:在乙烯分子中,每个碳原子的2s轨道与2个2p...