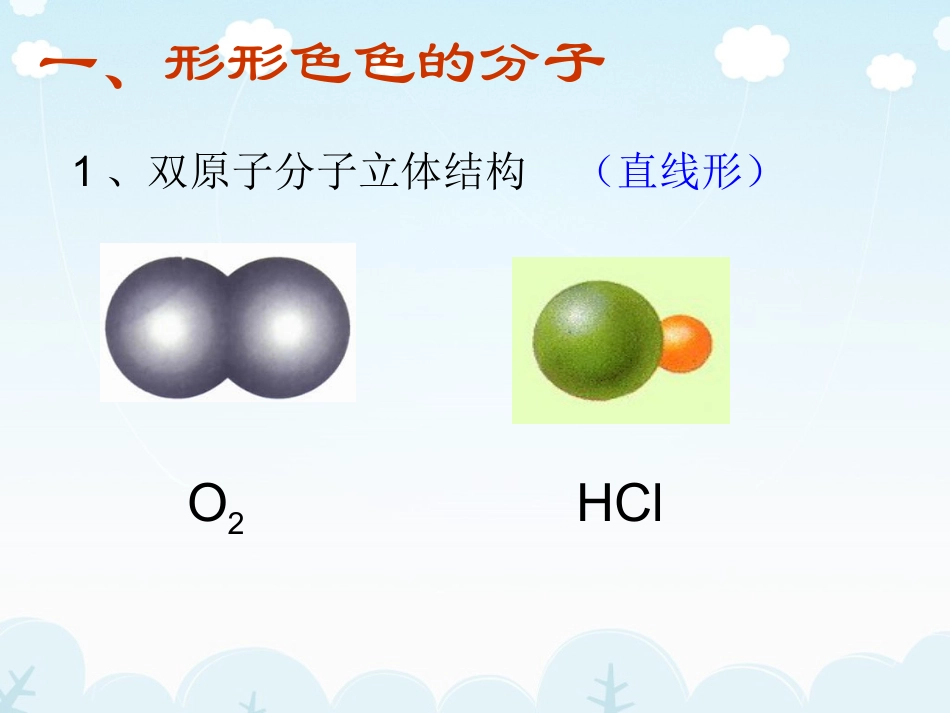
共价键σ键π键键参数键能键长键角衡量化学键的稳定性描述分子的立体结构的重要因素成键方式“头碰头”,呈轴对称成键方式“肩并肩”,呈镜像对称分子的立体结构一、形形色色的分子O2HCl1、双原子分子立体结构(直线形)1、利用几何知识分析一下,空间分布的三个点是否一定在同一直线或同一平面上?2、三个原子构成的分子,将这3个原子看成三个点,则它们在空间上可能构成几种形状?分别是什么?H2OCO22、三原子分子立体结构(有直线形和V形)3、四原子分子立体结构HCHONH3)(常见的是平面三角形、三角锥形)4、五原子分子立体结构最常见的是正四面体CH4C60C20C40C70资料卡片:形形色色的分子测分子立体结构:红外光谱仪→吸收峰→分析。1、同为三原子分子,CO2和H2O分子的空间结构却不同,什么原因?写出它们各自的电子式,试分析中心原子的价电子是否全部参加成键?直线形V形电子式OCO::::::::::::HOHHOH::分子的VSEPR模型分子结构::2、同为四原子分子,CH2O与NH3分子的的空间结构也不同,什么原因?写出它们各自的电子式,试分析中心原子的价电子是否全部参加成键?三角锥形平面三角形::HCH:O:::::::::HNHHNHHH电子式分子的VSEPR模型分子结构::二、价层电子对互斥理论二、价层电子对互斥理论(VSEPR)应用:预测分子和离子构型内容:对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤对电子对)之间存在排斥力,将使分子中原子处于尽可能远的相对位置上,以使彼此之间斥力最小,分子体系能量最低能量最低,,价层电子对数•δ键个数=与中心原子结合的原子数=δ键个数+中心原子上的孤对电子对个数中心原子上的孤电子对个数=½(a-xb)a:中心原子的最外层电子数(对于阳离子:a为中心原子的最外层电子数减去离子的电荷数;对于阴离子:a为中心原子的最外层电子数加上离子的电荷数)x为与中心原子结合的原子数b为与中心原子结合的原子最多能接受的电子数(H为1,其他原子为“8-该原子的最外层电子数)孤电子对的计算分子或离子中心原子axb中心原子上的孤电子对数SO2SNH4+NCO32-C615-1=404+2=60224132价电子对的空间构型即价电子对的空间构型即VSEPRVSEPR模模型型电子对数目电子对数目::234234VSEPRVSEPR模型模型::直线平面三角形正四面体直线平面三角形正四面体价层电子对互斥模型1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:ABn立体结构范例n=2直线形CO2、CS2n=3平面三角形CH2O、BF3n=4正四面体形CH4、CCl42.另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。中心原子的孤对电子也要占据中心原子的空间,并与成键电子对并与成键电子对互相排斥互相排斥。。分子的VSEPR模型分子立体构型3:::HCH:HH::::::HNHHNH::HH::::::HOHHOH::::::HCHHCH::OO::::::02222431NH3440CH43CH2O4H2OCO2价层电子对数σ键电子对数中心原子孤对电子对数电子式代表物0OCO::::::::VSEPR模型:直线形:直线形分子立体构型:直线形VSEPR模型:四面体:四面体分子立体构型:V形VSEPR模型::平面三角形平面三角形分子立体构型:平面三角形平面三角形VSEPR模型::正四面体正四面体分子立体构型:正四面体正四面体VSEPR模型::四面体四面体分子立体构型:三角锥三角锥应用反馈:化学式中心原子孤对电子数σ键电子对数VSEPR模型空间构型H2SBF3SO22023V形平面三角形V形12平面三角形四面体平面三角形1.下列物质中,分子的立体结构与水分子相似的是()A.CO2B.H2SC.NH3D.CCl4B2.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的()A.若n=2,则分子的立体构型为V形B.若n=3,则分子的立体构型为三角锥形C.若n=4,则分子的立体构型为正四面体形D.以上说法都不正确CABn型分子的VSEPR模型和立体结构VSEPR模型成键电子对数孤对电子对数分子类型电子对的排布方式立体结构实例直线形23平面三角形20AB2直线形CO230AB321AB2价层电子对数平面三角形BF3V形SO2价层电子对数VSEPR模型成键电子对数孤对电子对数分子类型电子对的排布分子构型实例方式4四面体40AB431AB322AB2正四面体CH4三角锥形NH3V形H2O