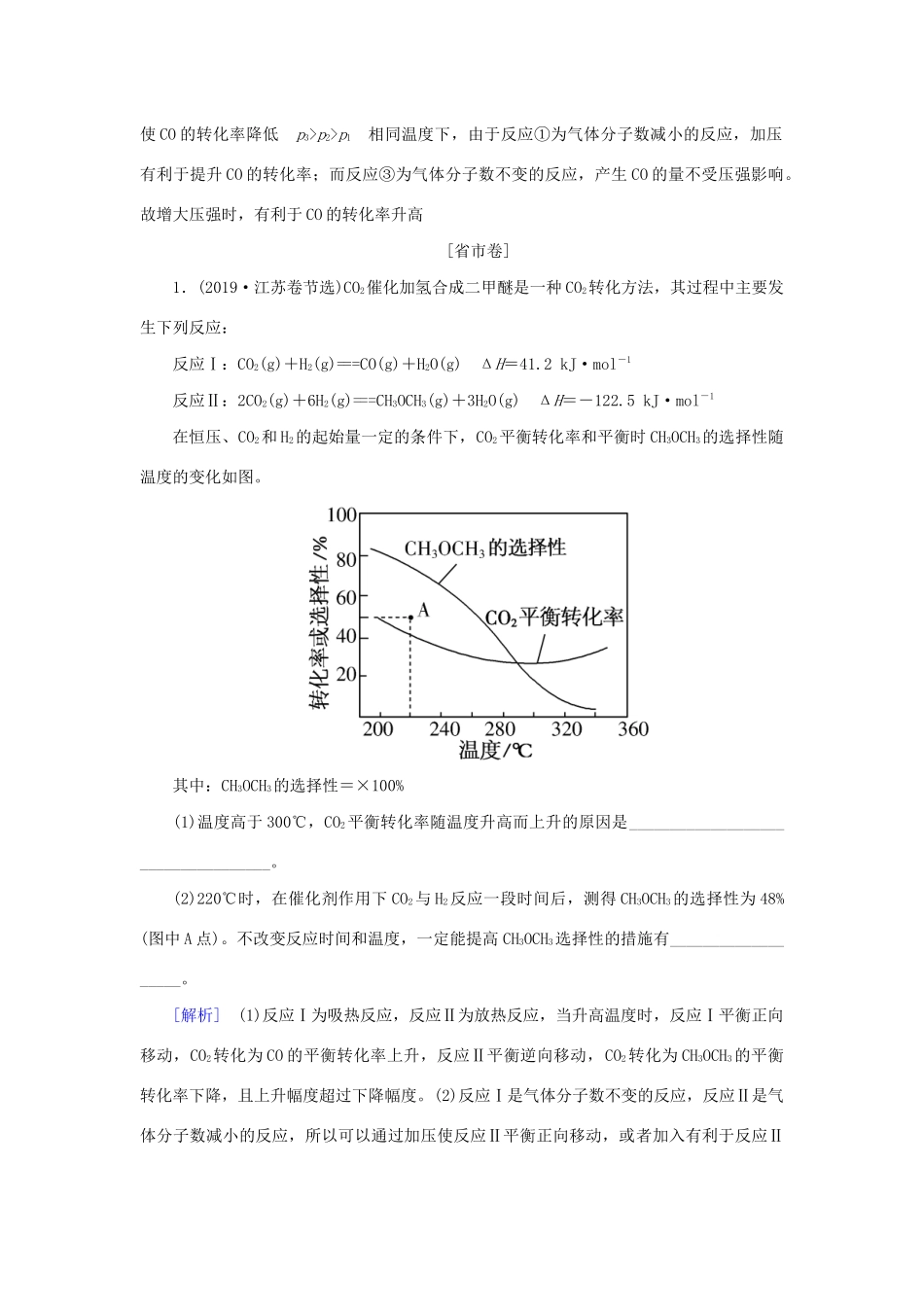
三陌生平衡图像的理解与分析[全国卷]1.(2017·全国卷Ⅱ节选)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:C4H10(g)===C4H8(g)+H2(g)ΔH=+123kJ·mol-1丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。如上图为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是_______________。[解析]由图像中的曲线变化趋势可知随着n(氢气)/n(丁烷)的增大,丁烯的产率先升高后降低,这是因为氢气为产物,丁烷为反应物,随着n(氢气)/n(丁烷)逐渐增大,逆反应速率(v逆)增大,当v正=v逆时丁烯的产率达到最高点,随后v逆>v正反应向逆反应方向进行,丁烯的产率降低,曲线呈下降趋势。[答案]氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大2.(2016·全国卷Ⅱ节选)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g)ΔH=-515kJ·mol-1②C3H6(g)+O2(g)===C3H4O(g)+H2O(g)ΔH=-353kJ·mol-1丙烯腈和丙烯醛的产率与的关系如图所示。由图可知,最佳约为________,理由是_____________________。[解析]由图可知,当=1时,丙烯腈的产率最高,而丙烯醛的产率已趋近于0,如果再增大,丙烯腈的产率反而降低,故最佳约为1。[答案]1该比例下丙烯腈产率最高,而副产物丙烯醛产率最低3.(2015·全国卷Ⅱ节选)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:①CO(g)+2H2(g)CH3OH(g)ΔH1=-99kJ·mol-1②CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2=-58kJ·mol-1③CO2(g)+H2(g)CO(g)+H2O(g)ΔH3=+41kJ·mol-1合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________;图中的压强由大到小为________,其判断理由是__________________________。[解析]由图像可知,压强一定时,CO的平衡转化率随温度的升高而减小,其原因是反应①为放热反应,温度升高,平衡逆向移动,产生CO的量增大,反应③为吸热反应,温度升高,平衡正向移动,又使产生CO的量增大,而总结果是随温度升高,CO的转化率减小。反应①的正反应为气体总分子数减小的反应,温度一定时,增大压强,平衡正向移动CO的平衡转化率增大,而反应③为气体总分子数不变的反应,产生CO的量不受压强的影响,因此增大压强时,CO的转化率提高,故压强p1、p2、p3的关系为p1
p2>p1相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高[省市卷]1.(2019·江苏卷节选)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:反应Ⅰ:CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=41.2kJ·mol-1反应Ⅱ:2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g)ΔH=-122.5kJ·mol-1在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=×100%(1)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是___________________________________。(2)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有___________________。[解析](1)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,当升高温度时,反应Ⅰ平衡正向移动,CO2转化为CO的平衡转化率上升,反应Ⅱ平衡逆向移动,CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降...