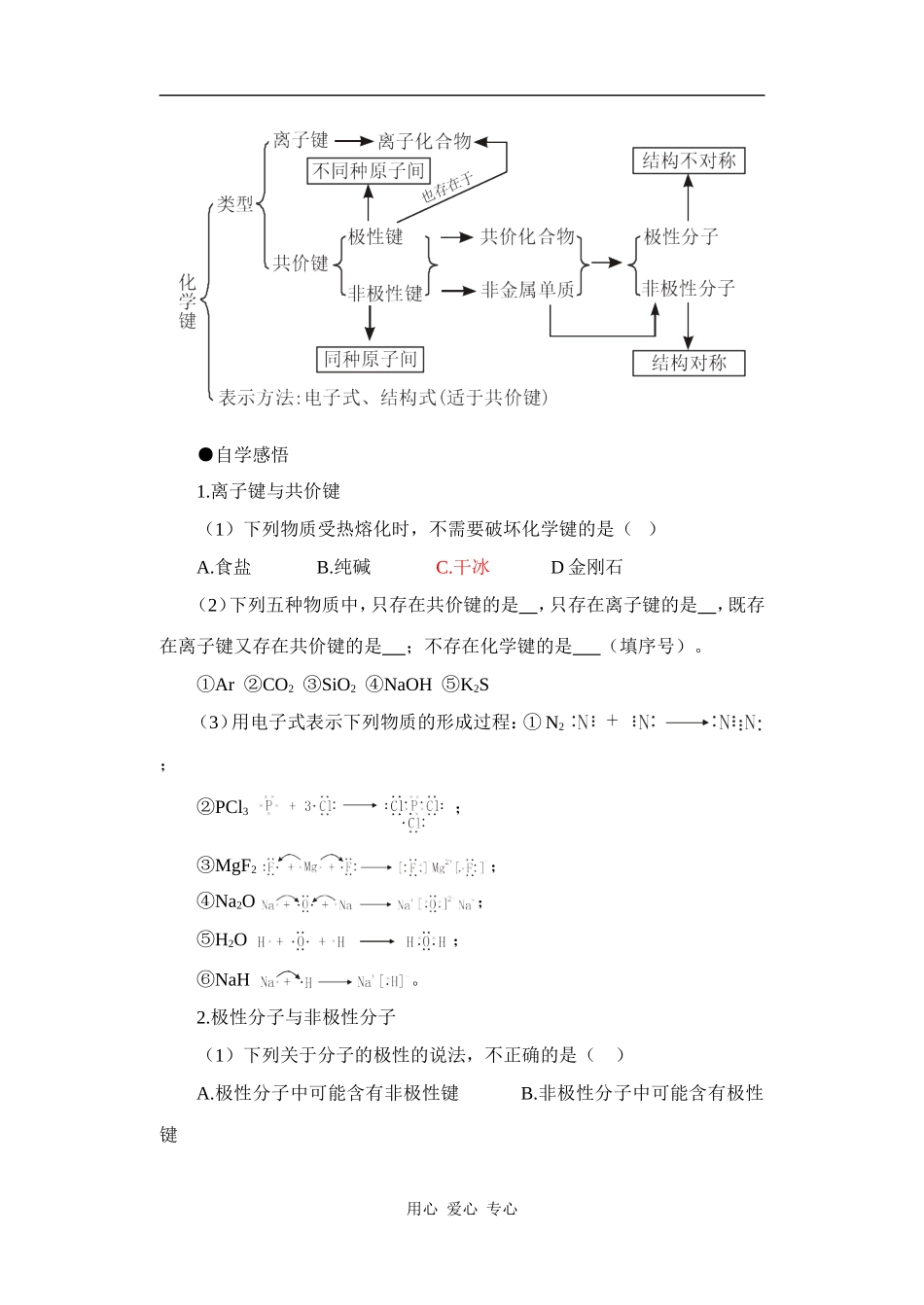
第五章物质结构元素周期律学案三、化学键与分子结构2008.10●教学点睛本部分包括高中化学教材第一册中的第五章第四自然节和第二册第一章第二节和第三册第一单元第一自然节等内容。主要考点有:①离子键、共价键的形成及特征;②用电子式表示离子化合物、共价化合物的形成;③极性键、非极性键、极性分子与非极性分子的概念;④极性分子、非极性分子的判断;⑤分子间作用力。复习本部分内容时应注意以下几点:(1)搞清化学键的概念,引导学生分析由于形成“稳定结构”,而导致元素的原子形成不同类型的化学键。常见的类型主要有离子键和共价键,列表进行比较。重点是让学生善于判断化合物中原子之间以何种键相结合,并能用电子式正确表示离子化合物和共价化合物的形成过程及化合物的结构。(2)引导学生写出常见物质(如N2、HCl、H2O、CO2、NH3等)的电子式和结构式,指出化学键类型,判断分子有无极性。在此基础上归纳总结分子的极性与共价键的极性之间的关系,判断分子极性的方法规律等。(3)在复习过程中,可启发学生分析思考下列问题:①卤素单质I2的熔点比Br2的熔点高,原因是什么?②为什么碘在四氯化碳中的溶解度比在水中的溶解度大?③为什么水的熔沸点比硫化氢的熔沸点高得多?归纳总结有关知识规律,强化知识的理解应用。(4)本部分内容复习可安排一课时。知识梳理●网络构建用心爱心专心●自学感悟1.离子键与共价键(1)下列物质受热熔化时,不需要破坏化学键的是()A.食盐B.纯碱C.干冰D金刚石(2)下列五种物质中,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是;不存在化学键的是(填序号)。①Ar②CO2③SiO2④NaOH⑤K2S(3)用电子式表示下列物质的形成过程:①N2;②PCl3;③MgF2;④Na2O;⑤H2O;⑥NaH。2.极性分子与非极性分子(1)下列关于分子的极性的说法,不正确的是()A.极性分子中可能含有非极性键B.非极性分子中可能含有极性键用心爱心专心C.极性分子中不一定只含有极性键D.非极性分子中只含有非极性键思考讨论1.举例说明书写物质的电子式时应注意的问题有哪些?提示:(1)阴离子和复杂阳离子(NH、CH)要加括号,并注明所带电荷数。如:等。(2)要注意化学键中原子直接相邻的事实。如MgBr2的电子式:,不能写作:Mg2+∶]。(3)要注意书写单质、化合物的电子式与单质、化合物形成过程电子式的差别。如CO2的电子式为∶∶∶C∶∶∶,CO2形成过程的电子式为∶∶+∶C∶+∶∶∶∶∶C∶∶∶(4)要熟练掌握一些重要物质的电子式的书写。如HClO:H∶∶∶;NaH:Na+[∶H]-;Na2O2:Na+[∶∶∶]2-Na+;HCl:H∶∶;NH3:H∶∶[NH4Cl:[H∶∶H]+[∶∶]-。2.分子的极性与共价键的极性有何关系?如何判断分子有无极性?提示:极性分子中一定含有极性键,由极性键构成的分子不一定是极性用心爱心专心分子。判断分子有无极性的方法是:首先看键是否有极性,然后再看各键的空间排列状况。键无极性,分子必无极性;键有极性,各键空间排列均匀,使键的极性相互抵消,分子无极性。各键空间排列不均匀,不能使键的极性相互抵消,分子有极性。疑难突破1、化学键与物质类别规律(1)只含非极性共价键的物质:同种非金属元素构成的单质,如I2、N2、P4、金刚石、晶体硅等。(2)只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。如HCl、NH3、SiO2、CS2等。(3)既有极性键又有非极性键的物质:如H2O2、C2H2、CH3CH3、C6H6(苯)等。(4)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CsCl、K2O、NaH等。(5)既有离子键又有非极性键的物质,如Na2O2、Na2Sx、CaC2等。(6)只有共价键,没有范德瓦耳斯力的物质——金刚石、单晶硅、SiO2、SiC。(7)无化学键的物质——稀有气体。2、极性分子与非极性分子(1)分子极性的判断分子的极性由共价键的极性及分子的空间构型两方面共同决定:①以极性键结合而形成的异核双原子分子都是极性分子,如HCl。②以非极性键结合而形成的同核双原子分子都是非极性分子,如Cl2。③以极性键结合而形成的多原子分子,既有极性分子,又有非极性分子,分子的空间构...