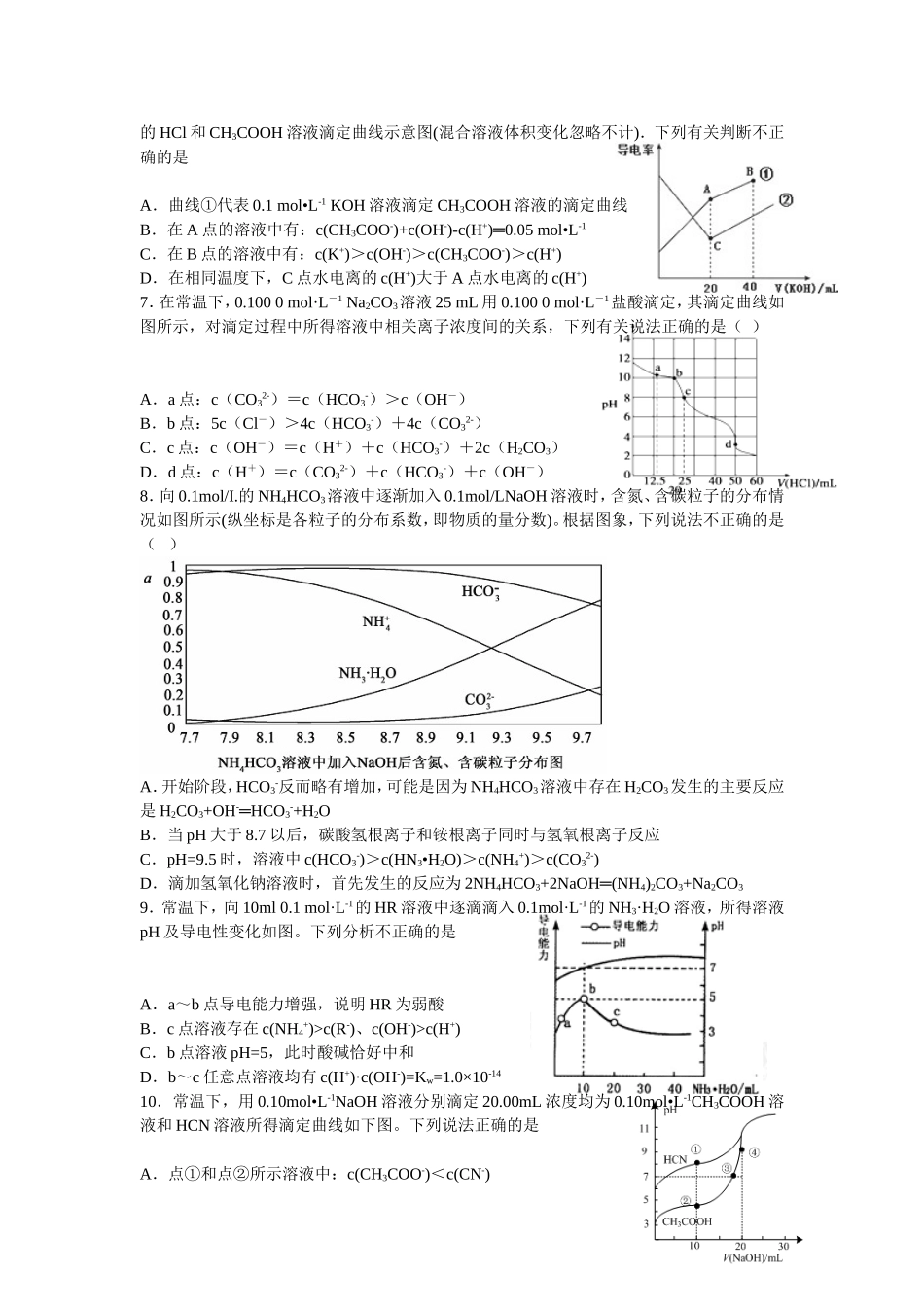
图像类离子浓度比较专项训练1.用0.1mol·L-1的NaOH溶液滴定25mL0.1mol·L-1的H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是()A.草酸是弱酸B.X点:c(H2C2O4)+c(HC2O4-)=c(Na+)-c(C2O42-)C.Y点:c(H2C2O4)+c(HC2O4-)=c(OH-)-c(H+)D.滴定过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)2.常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是A.b、c两点溶液的导电能力相同B.a、b、c三点溶液中水的电离程度a>c>bC.c点溶液中c(H+)=c(OH-)+c(CH3COOH)D.用等浓度的盐酸分别与等体积的b,c处溶液恰好完全反应,消耗盐酸体积Vb=Vc3.常温下,向20mL某浓度的盐酸中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是A.盐酸的物质的量浓度为lmol/LB.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L4.常温下,用0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是A.当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)5.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是()A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)C.随着CO2的通入,不断增大D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成6.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。右图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是A.曲线①代表0.1mol•L-1KOH溶液滴定CH3COOH溶液的滴定曲线B.在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05mol•L-1C.在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)D.在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+)7.在常温下,0.1000mol·L-1Na2CO3溶液25mL用0.1000mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是()A.a点:c(CO32-)=c(HCO3-)>c(OH-)B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-)8.向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是()A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2OB.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应C.pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-)D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO39.常温下,向10ml0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是A.a~b点导电能力增强,说明HR为弱酸B.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)C.b点溶液pH=5,此时酸碱恰好中和D.b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-1410.常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)D.点②和点③所示溶液中...