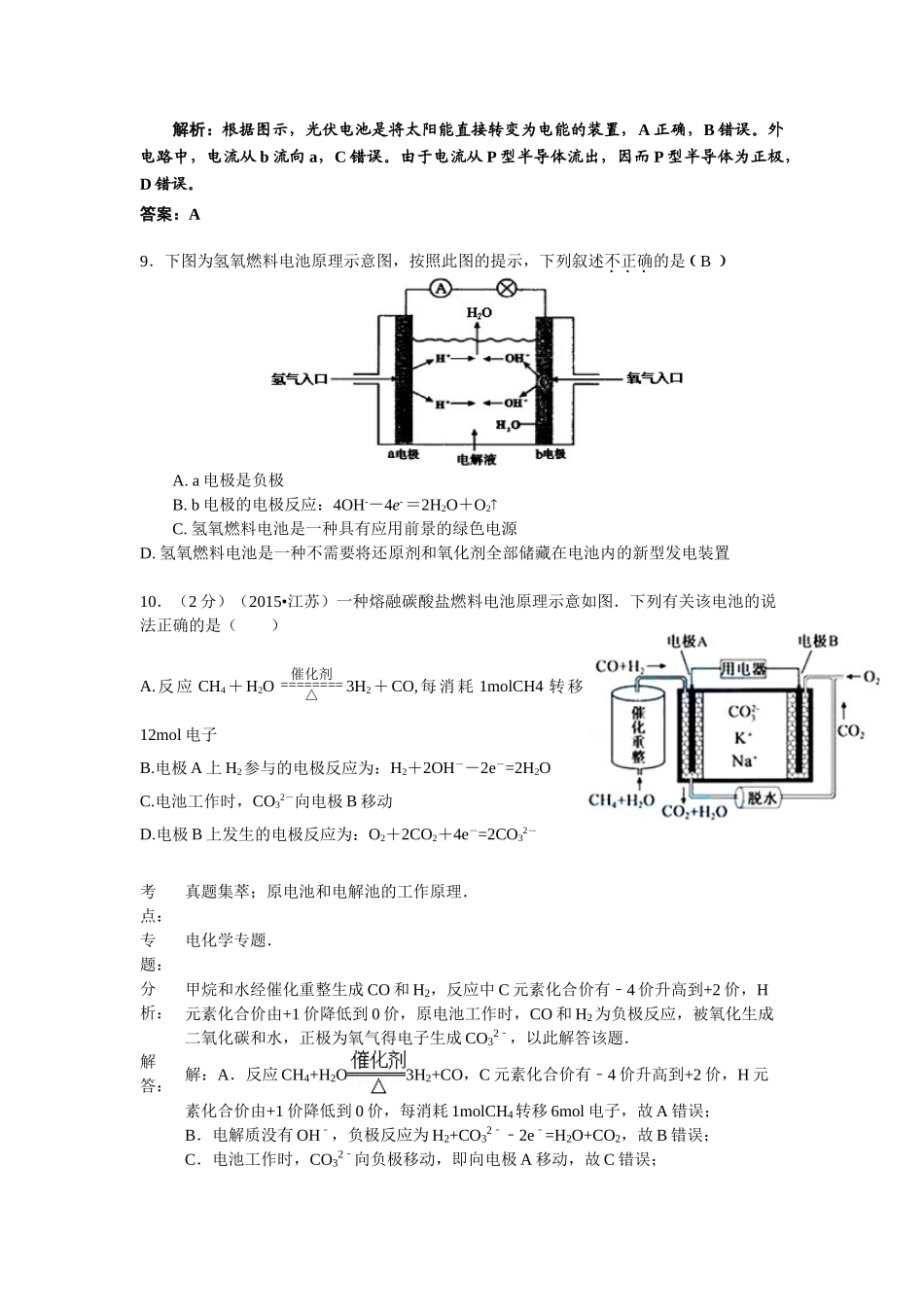
原电池综合测试一、单项选择题:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合题意.1.下面是几种常见的化学电源示意图,有关说法不正确的是()A.上述电池分别属于一次电池、二次电池和燃料电池B.干电池在长时间使用后,锌筒被破坏C.铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207gD.氢氧燃料电池是一种具有应用前景的绿色电源解析:选项A正确。在干电池中,Zn作负极,被氧化,B正确。氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内,且工作的最终产物是水,故氢氧燃料电池是一种具有应用前景的绿色电源,D正确。C项忽略了硫酸铅在该极上析出,该极质量应该增加而非减小。答案:C2、市场上经常见到一种标记为Li—ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电极反应式为:Li+2Li0.35NiO22Li0.85NiO2下列说法不正确的是:(D)A.放电时,负极的电极反应式为:Li-e-=Li+B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应C.该电池不能用水溶液作为电解质D.放电过程中Li+向负极移动3、(2011浙江高考10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是A.液滴中的Cl―由a区向b区迁移B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH-C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-Cu2+4.家用炒菜铁锅用水清洗后,放置一会出现红棕色的铁锈,在此变化过程中不会发生的化学变化是A.2Fe+O2+2H2O=2Fe(OH)2B.4Fe(OH)2+O2+2H2O=4Fe(OH)3C.O2+2H2O+4e-→4OH-D.Fe→Fe3++3e-5.下列反应不可能是原电池反应的是()A.Fe+2H+=Fe2++H2↑B.2Fe3++Cu=2Fe2++Cu2+C.2H2+O2=2H2OD.H++OH-=H2O6.人造卫星用到的一种高能电池—银锌电池,其电极反应为:Zn+2OH--2e=Zn(OH)2Ag2O+H2O+2e=2Ag+2OH-根据反应式判断氧化银是()A.负极被氧化B.正极被还原C.负极被还原D.正极被氧化7.等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是(D)CD8.世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下列有关叙述正确的是()A.光伏电池是将太阳能转变为电能B.光伏电池是将化学能转变为电能C.电流从a流向bD.图中N型半导体为正极,P型半导体为负极解析:根据图示,光伏电池是将太阳能直接转变为电能的装置,A正确,B错误。外电路中,电流从b流向a,C错误。由于电流从P型半导体流出,因而P型半导体为正极,D错误。答案:A9.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是BA.a电极是负极B.b电极的电极反应:4OH-4e=2H2O+O2C.氢氧燃料电池是一种具有应用前景的绿色电源D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置10.(2分)(2015•江苏)一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是()A.反应CH4+H2O=====点燃=======通电=======电解========催化剂△3H2+CO,每消耗1molCH4转移12mol电子B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2OC.电池工作时,CO32-向电极B移动D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-考点:真题集萃;原电池和电解池的工作原理..专题:电化学专题.分析:甲烷和水经催化重整生成CO和H2,反应中C元素化合价有﹣4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32﹣,以此解答该题.解答:解:A.反应CH4+H2O3H2+CO,C元素化合价有﹣4价升高到+2价...