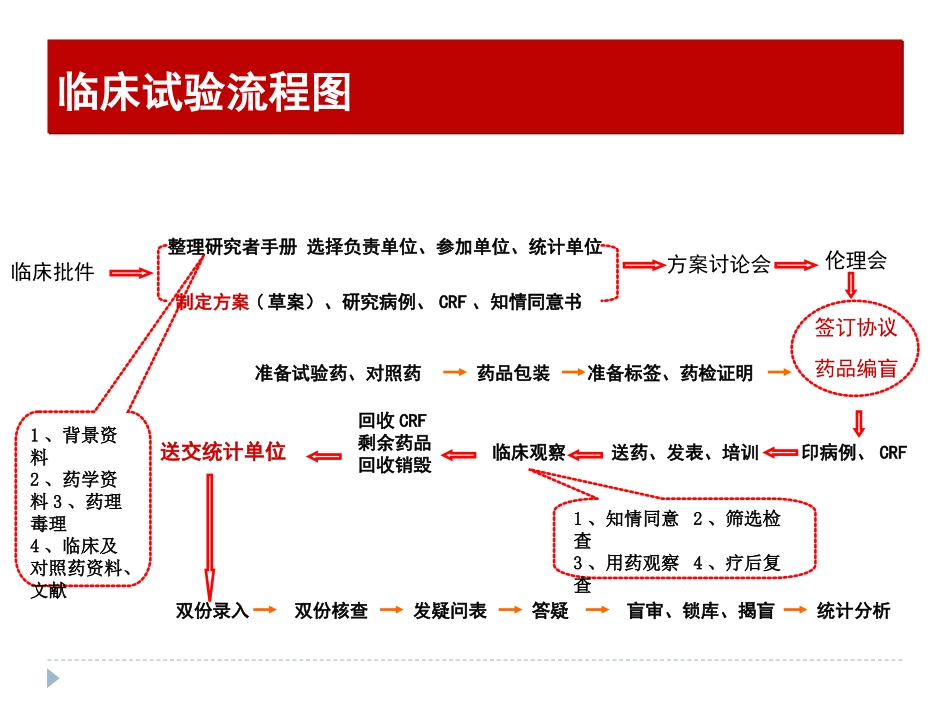
临床试验启动会准备试验药、对照药印病例、CRF送药、发表、培训临床观察回收CRF剩余药品回收销毁送交统计单位双份录入双份核查发疑问表答疑盲审、锁库、揭盲统计分析1、知情同意2、筛选检查3、用药观察4、疗后复查1、背景资料2、药学资料3、药理毒理4、临床及对照药资料、文献临床批件整理研究者手册选择负责单位、参加单位、统计单位制定方案(草案)、研究病例、CRF、知情同意书方案讨论会伦理会签订协议药品编盲药品包装准备标签、药检证明临床试验流程图临床试验流程图临床试验会议1.内部项目启动会;2.方案讨论会;3.伦理会*;4.研究中心启动会;5.中期会*;6.数据审核会;7.总结会;8.其他:沟通会(研究者、CRA、PM)研究中心启动会任务:培训研究者;试验药品、资料的运输与交接;研究者团队的确立和分工;研究者文件夹的建立、基地资料备案;*临床试验在当地省局备案。研究中心启动会标准:完成培训会的召开,收回签到表,撰写会议经要,获得正常值范围,返回后资料存档;完成试验药品与资料的交接,交接单上签字并收回存档;研究者文件夹建立并妥善保存;基地需要的备案资料已提交;*试验的备案资料已交当地省局安监处(有回执的应带回存档)。研究中心启动会--会前的准备培训会时间与地点的确定与科室负责人联系:确定会议相关负责人;与临床研究机构负责人联系:告知将准备开启动会,了解相关程序;与会议负责人联系:明确会议的时间、地点(哪栋楼、哪个会议室),参会的人员名单,是否用餐(标准);会议的时间与地点确定后:通知机构负责人,,并请科室的会议负责人或主任通知其它参加会议的科室人员。会议资料的准备会议计划:时间、地点、与会人员名单、需要准备的资料及物品等。会议资料:方案幻灯片的电子版及打印版、CRF表样表、知情同意书样表,书面材料参会人员人手一份。GCP培训资料,可作一简单培训。会议签到表一份。培训内容:简易方案(重点是入选标准、排除标准、药品使用、试验流程、评价方法、注意事项等);临床试验的计划安排;病历表、CRF表的填写要求。研究中心启动会--会前的准备会议资料的准备会议计划:时间、地点、与会人员名单、需要准备的资料及物品等。会议资料:方案幻灯片的电子版及打印版、CRF表样表、知情同意书样表,书面材料参会人员人手一份。GCP培训资料,可作一简单培训。会议签到表一份。培训内容:简易方案(重点是入选标准、排除标准、药品使用、试验流程、评价方法、注意事项等);临床试验的计划安排;病历表、CRF表的填写要求。研究中心启动会--会前的准备会议物品的准备签到表、研究者简历、任务分工授权表、签名样张等;培训会资料;研究者文件夹(成套);礼品;适量的水及水果等;笔记本电脑、投影仪;签字笔等。研究中心启动会--会前的准备可由主要研究者(主任)主持,由临床监查员讲解试验方案;方案中受试者的筛选标准、试验过程、各随访期观察项目与实验室检查项目以及疗效评价等内容应做重点的讲解;讲解CRF表、原始病历表等资料的填写要求等;在讲解中或讲解后,可由与会人员提出相关疑问,监查员予以解答说明,直到研究者对方案内容均理解为止。试验的进度计划、监查访视计划等。会后根据计划安排研究者用餐或进行其它活动;培训会后写出会议纪要,主要研究者签字,基地及我方各留一份存档;交接物资、试验相关文档,均须有文字记录。研究中心启动会--培训会的召开对照监查访视计划,检查各项工作完成情况,填写启动访视报告;汇报工作—PM;费用报销;跟进入组进展。研究中心启动会--结束后的工作谢谢!谢谢!