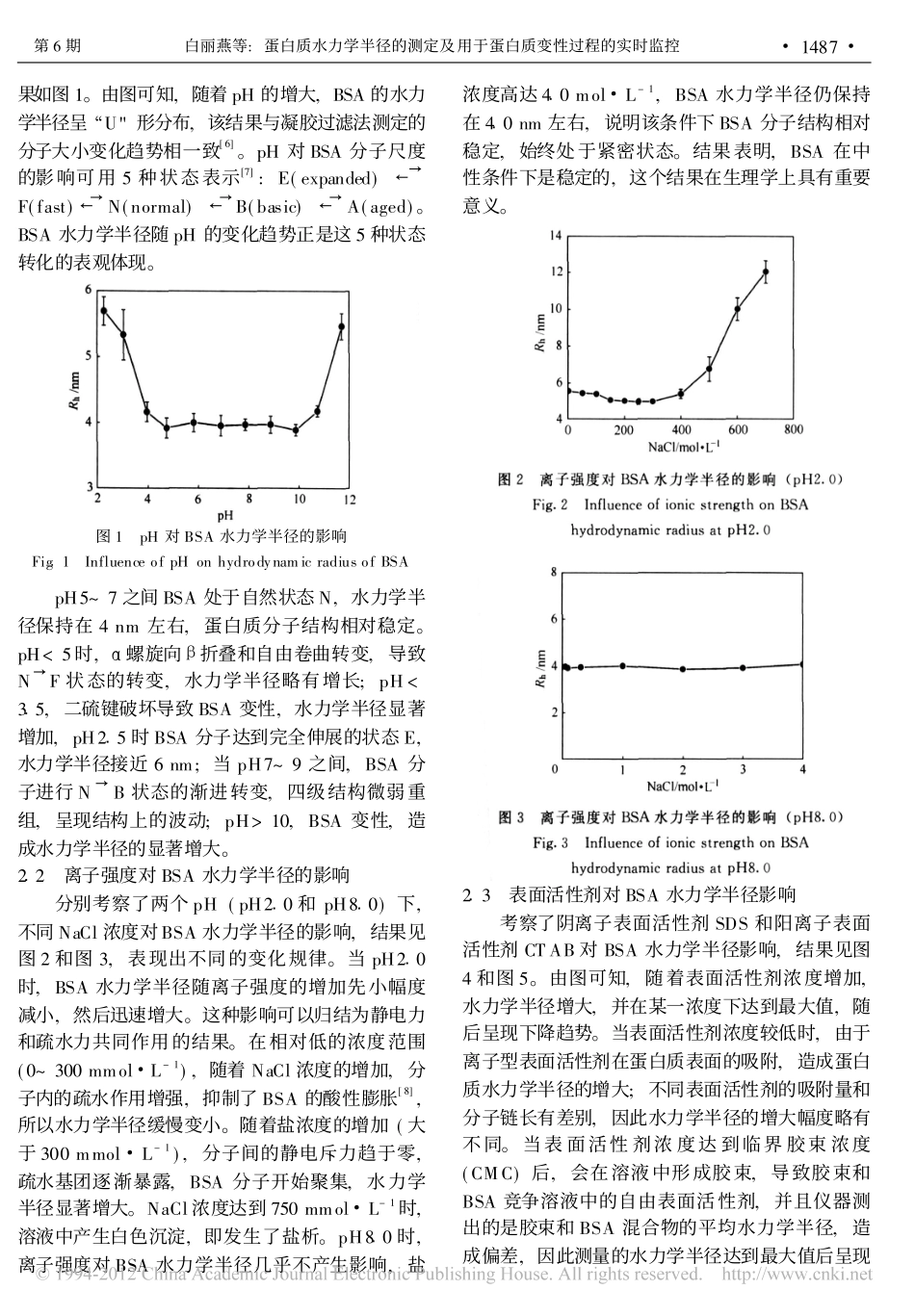
第59卷第6期化工学报Vol159No162008年6月JournalofChemicalIndustryandEngineering(China)June2008研究论文蛋白质水力学半径的测定及用于蛋白质变性过程的实时监控白丽燕1,陈春琴2,林东强1,姚善泾1(1浙江大学化学工程与生物工程学系,浙江杭州310027;2杭州华东大药房连锁有限公司,浙江杭州310002)摘要:采用纳米粒度分析仪ZetasizerNano测定了牛血清白蛋白(BSA)的水力学半径,考察了pH、离子强度、表面活性剂等的影响,并用于BSA热变性和脲变性过程的实时跟踪。随pH增大,BSA水力学半径呈/U0形变化趋势;酸性条件下,分子膨胀,随着盐浓度升高,BSA分子先小幅减小后显著增大;中性pH范围,离子强度对蛋白质分子尺寸影响很小,蛋白质性质相对稳定。离子型表面活性剂在蛋白质表面吸附,从而影响BSA水力学半径。通过水力学半径的测量实时跟踪蛋白质变性过程的分子变化,发现增加热变性中离子强度可加快变性速率,SDS加入增大了BSA变性温度Tm。脲在促使BSA分子扩张的同时,对链伸展有抑制作用;在DTT存在下,BSA的水力学半径随着时间变化逐渐增大。结果表明,简便的水力学半径测量可以用于蛋白质大小的表征,并可实时跟踪蛋白变性过程的分子尺度变化。关键词:水力学半径;牛血清白蛋白;表面活性剂;热变性;脲中图分类号:TQ93文献标识码:A文章编号:0438-1157(2008)06-1485-05MeasurementofproteinhydrodynamicradiusanditsapplicationstomonitorproteindenaturationBAILiyan1,CHENChunqin2,LINDongqiang1,YAOShanjing1(1DepartmentofChemicalandBiochemicalEngineering,ZhejiangUniversity,Hangzhou310027,Zhejiang,China;2HuadongMedicineCo1,Ltd1,Hangzhou310002,Zhejiang,China)Abstract:Thehydrodynamicradius(Rh)ofbovineserumalbumin(BSA)wasmeasuredwiththeZetasizerNanoinstrument1TheinfluencesofpH,ionicstrengthandsurfactantswereinvestigated,andtherea-ltimemeasurementofBSAsizewasusedtomonitorthethermaldenaturationandureadenaturationofBSA1TheresultsindicatedthatRhshowedatypical/U0formwiththeincreaseofpH1Inacidsolution,withincreasingionicstrengththeRhdecreasedalittlefirst,andthenincreasedremarkably1AtneutralpHtheinfluenceofionicstrengthcouldbeneglected1TheadsorptionofionicsurfactantsonBSAmolecularsurfaceresultedinthechangeofRh1ForthethermaldenaturationofBSA,therateofdenaturationincreasedwiththeincreaseofionicstrength1Whensodiumdodecylsulfate(SDS)wasadded,themeltingpointTmofBSAcouldincrease1Forureadenaturation,ureacouldcauseBSAmoleculetoexpandbutalso2007-08-13收到初稿,2008-01-09收到修改稿。联系人:姚善泾。第一作者:白丽燕(1983)),女,硕士。基金项目:国家高技术研究发展计划项目(2006AA02Z210);国家自然科学基金项目(20206029,20776129)。Receiveddate:2007-08-13.Correspondingauthor:Prof.YAOShanjing.E-mail:yaosj@zju1edu1cnFoundationitem:supportedbytheHigh-techResearchandDevelopmentProgramofChina(2006AA02Z210)andtheNationalNaturalScienceFoundationofChina(20206029,20776129).restraintheextensionofpeptidechains1Byaddingdithiothreitol(DTT),theRhofBSAincreasedgraduallywithdenaturationtime1TheresultsindicatedthatthisconvenientmeasurementofRhcouldbeusedforcharacterizingthemolecularsizeofprotein,andmonitoringthechangeofproteinmoleculeduringthedenaturationprocess.Keywords:hydrodynamicradius;bovineserumalbumin;surfactant;thermaldenaturation;urea引言随着生物技术工业的快速发展,对下游分离纯化过程提出了越来越高的要求。采用有效的表征手段,准确、快速、实时地测定蛋白质分子的分子量、空间尺度、表面电荷特性等参数,可以为下游过程的优化和设计提供指导[1-2]。文献报道,通过检测不同条件下酵母乙醇脱氢酶的大小,可协助选择最佳微滤条件,大大提高了分离收率[3]。常规测量蛋白质大小的方法,如电泳和凝胶过滤法,需要标准蛋白作为参照,且过程费时费力。常见的粒度分析方法有显微镜法、沉降法、...