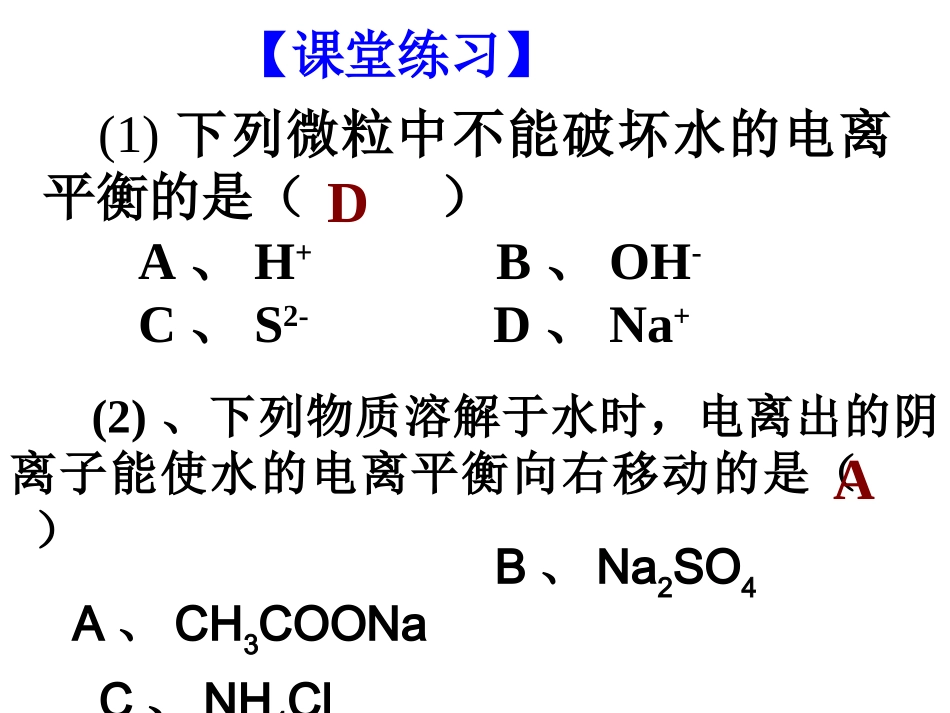
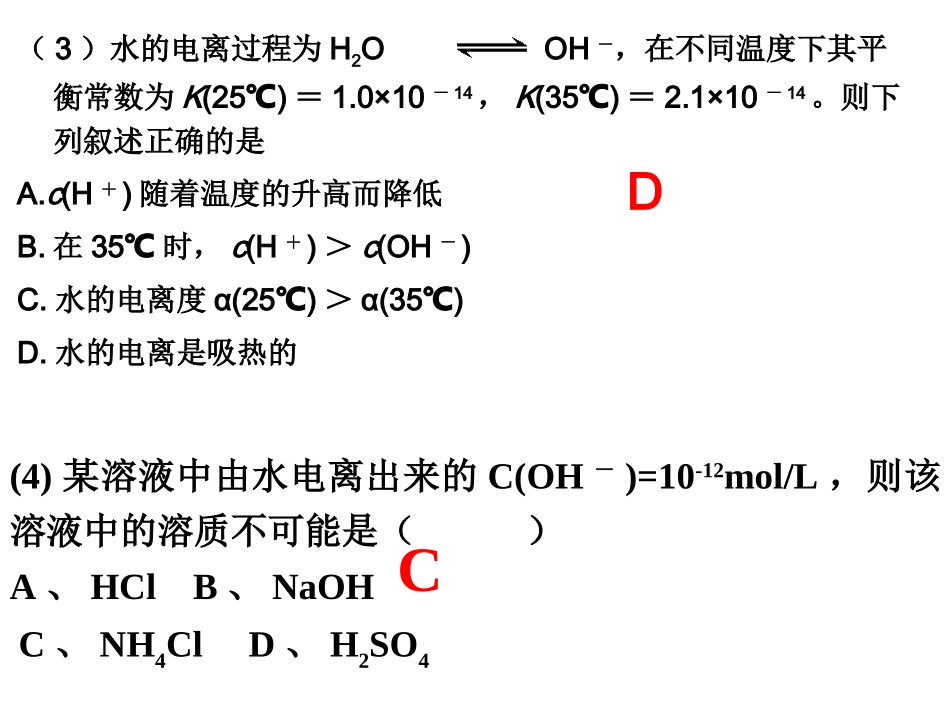
(2)、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是()A、CH3COONaB、Na2SO4C、NH4ClD、CH3COOHA(1)下列微粒中不能破坏水的电离平衡的是()A、H+B、OH-C、S2-D、Na+D【课堂练习】(4)某溶液中由水电离出来的C(OH-)=10-12mol/L,则该溶液中的溶质不可能是()A、HClB、NaOHC、NH4ClD、H2SO4C(3)水的电离过程为H2OH++OH-,在不同温度下其平衡常数为K(25)℃=1.0×10-14,K(35)℃=2.1×10-14。则下列叙述正确的是A.c(H+)随着温度的升高而降低B.在35℃时,c(H+)>c(OH-)C.水的电离度α(25)℃>α(35)℃D.水的电离是吸热的D三、溶液的酸碱性与pH值1、定义:化学上常采用H+的物质的量浓度的负对数来表示溶液的酸碱性。3、溶液的酸碱性与pH值的关系酸性溶液:c(H+)>c(OH—)pH<7中性溶液:c(H+)=c(OH—)pH=7碱性溶液:c(H+)
72、表示方法:pH=-lg{c(H+)}注意1、PH值越小,酸性越强,PH越大,碱性越强。2、PH范围0---14之间。3、PH值等于0的溶液不是酸性最强的溶液,PH值等于14的溶液不碱性最强的溶液。4、PH值减小一个单位,[H+]扩大为原来的10倍,PH增大一个单位,[H+]减为原来的1/10[OH—]增为原来的10倍讨论:pH试纸的使用能否直接把pH试纸伸到待测液中?是否要先湿润pH试纸后,再将待测液滴到pH试纸上?能否用pH试纸测出pH=7.1?标准比色卡中的数据都是整数使用方法:直接把待测液滴在干燥的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比定量测定:pH试纸法4、pH值测定方法酸碱指示剂法、pH试纸法、pH计法等。有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。(1)该学生的操作是___________“”“(填正确的或不”正确的),其理由是(2)请分析上述操作是否一定有误差?。(3)若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是___________,原因是(4)某同学用pH试纸测出某溶液的pH为3.82,你认为合理吗?。溶液的酸碱性---正误判断1、如果[H+]=10-7mol/L,则溶液一定呈现中性。2、在水中加酸会抑制水的电离。3、如果[H+]/[OH-]的值越大则酸性越强。4、任何水溶液中都有[H+]和[OH-]。5、[H+]等于10-6mol/L的溶液一定呈现酸性。6、对水升高温度电离度增大,酸性增强。×√√√有关溶液pH的计算:1、单一溶液的计算:2、强酸、强碱的稀释:例1、0.001mol/L盐酸的pH=__________,加水稀释到原来的10倍,pH=________例2、pH=10的NaOH溶液加水稀释到原来的100倍,则溶液的pH=___________结论:强酸(碱)每稀释10倍,pH值向7靠拢一个单位;注意:pH=6或8时,不可忽略水的电离,只能接近7酸碱溶液无限稀释,pH只能约等于7或接近7:酸不能大于7;碱不能小于73、弱酸、弱碱的稀释练习1、将pH=10的NaOH溶液稀释100和10000倍后,溶液的pH是多少?练习2、将pH=10的氨水稀释100倍后后,溶液的pH是8,对吗?小结:对于强碱溶液(pH=b)每稀释10n倍,pH减小n个单位,即pH=b-n;对于弱碱溶液(pH=b),每稀释10n倍,pH的范围是b-n