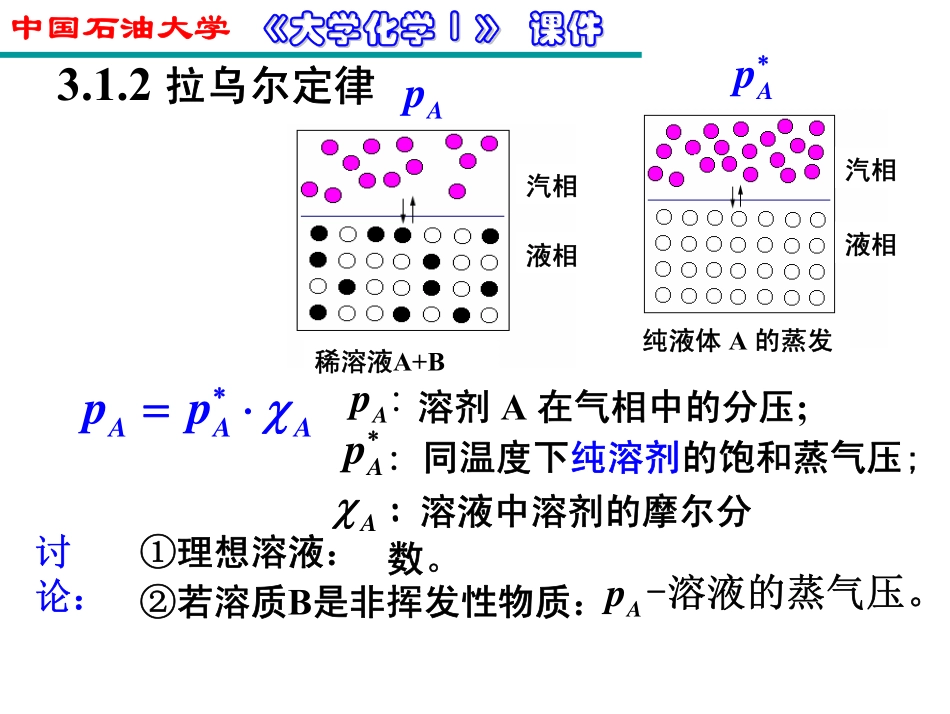
§3.1溶液)()BBmolbkg=溶质的物质的量(溶剂的质量Bmwm=溶质溶液=)()BBmolcL溶质的物质的量(混合物体积=BBnxn总[例3-1]23g乙醇溶于500g水中,此溶液的密度是0.992g·mL-1。计算:(1)乙醇的质量摩尔浓度b;(2)乙醇的体积摩尔浓度c(物质的量的浓度);(3)乙醇的质量分数;(4)乙醇的摩尔分数。第三章水溶液中酸碱平衡和沉淀平衡中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件3.1.1溶液组成的表示方法∗=⋅AAAppχ:同温度下纯溶剂的饱和蒸气压;Ap∗Aχ:溶液中溶剂的摩尔分数。Ap:溶剂A在气相中的分压;3.1.2拉乌尔定律纯液体A的蒸发液相汽相∗Ap稀溶液A+B液相汽相Ap中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件②若溶质B是非挥发性物质:①理想溶液:讨论:Ap-溶液的蒸气压。BBABnnnχ=+Δ=⋅*ABppχ*AApppΔ=−(/)BBAAAnnnmM≈=ABMb=⋅1、稀溶液蒸气压下降3.1.3稀溶液的依数性*AABBppMbKbΔ≈⋅⋅=⋅�难挥发的非电解质稀溶液,蒸气压下降值只取决于溶剂的本性及溶液的质量摩尔浓度。中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件沸点升高值:2、稀溶液的沸点上升Kb=0.515K·kg-1·mol-1*bbbTTTΔ=−bbBTKbΔ=⋅Kb--溶剂的摩尔沸点上升常数。p16:表1.3一些溶剂的摩尔沸点上升常数思考:浓度同为0.01mol·kg-1的丙三醇的乙醇溶液和水溶液,它们的沸点升高值是否相同?中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件3、稀溶液凝固点下降溶液凝固点降低值:Kf=1.853K·kg-1·mol-1*fffTTTΔ=−ffBTKbΔ=⋅Kf---溶剂摩尔凝固点下降常数。[例3-2]0.9g醋酸溶于50.0g水中,实验测得溶液的凝固点为272.59K,求醋酸的摩尔质量。p16:表1.3一些溶剂的摩尔凝固点下降常数中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件6第四周作业情况化学平衡有关计算(p260:1,7,9,3,4,8)7、计算反应在500℃时反应的标准摩尔吉布斯函数变和标准平衡常数。CO(g)+H2O(g)=CO2(g)+H2(g)298298()()()rmrmrmGTHKTSKϑϑϑΔ≈Δ−⋅Δ()()lnrmGTRTKTϑϑΔ=−单位一致错误:T=773.15K29815()(.)rmfmGTKGKϑϑΔ←Δ79、已知反应:2SO2(g)+O2(g)=2SO3(g)在1062K时的标准平衡常数及某状态时各组分的分压,判断反应进行的方向。Q与Kθ关系QKQKQKϑϑϑ⎧<⎪>⎨⎪⎩,正向自发,逆向自发=,化学平衡错误:pθQKϑ==>⋅221{25.3/100}1.152{30.4/100}{60.1/100}83、H2(g)+I2(g)==2HI(g)/:nmol始2.02.0/:nmol平衡2.0-x2.0-x2x平衡时总摩尔数:4.0nmol总=22.04.01002.02.04.01004.0100()()()pxppxxKϑ−−⋅=⋅⋅55.3=设平衡时系统总压为pkPa/:eqpkPa2.04.0xp−⋅2.04.0xp−⋅24.0xp⋅2(2.0)(2.0)(2.0)xKxxϑ=−−错误:94、FeO(s)+CO(g)=Fe(s)+CO2(g)/(/):cmolL始0.050.01/(/):eqcmolL0.05-x0.01+x0.010.061000.050.06100()()pxpxKϑ+−⋅=⋅0.5=设平衡时系统体积为VL/:nmol平衡(0.05-x)·V(0.01+x)·V/:eqpkPa(0.05)0.06xVpV−⋅(0.01)0.06xVpV+⋅2()/(0.01)()/(0.05)eqeqcCOcxKcCOcxϑϑϑ+==−错误:108、已知反应C(s)+CO2(g)=2CO(g);Kθ(1042K)=4.6,Kθ(940K)=0.05。求上述反应的ΔrHmθ、ΔrSmθ、ΔrGmθ(940K)。221121lnrmHKTTKRTTθϑϑ⎛⎞Δ−=⎜⎟⎝⎠()9408314940005.ln.(/)rmGKJmolϑΔ=−××298298()()()rmrmrmGTHKTSKϑϑϑΔ≈Δ−⋅Δ错误:fmHθΔfmGθΔmSθrmHθΔrmGθΔrmSθΔ4.61042940ln0.058.3141042940rmHθΔ−⎛⎞=⎜⎟×⎝⎠中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件第⑿次作业:补充题1,2。预习:p274~276;p285~287。bbBTKbΔ=⋅BpKbΔ≈⋅稀溶液的依数性ffBTKbΔ=⋅AAAppχ∗=⋅稀溶液A+B液相汽相Л--溶液的渗透压;V--溶液的体积;n--溶液中溶质物质的量;R--摩尔气体常数;T---热力学温度。4、渗透压(osmoticpressure)VnRTπ=①溶液渗透压的依数性。②溶液渗透压的普遍性。③反渗透技术。πcRT=中国石油大学《《大学化学大学化学Ⅰ》Ⅰ》课件课件讨论:�仅适用于难挥发、非电解质、稀溶液。�对于浓溶液、电解质溶液:且蒸气压下降值、沸点升高值、凝固点下降值、渗透压数值比非电解质稀溶液更大,但不符合上述定量公式。BKb≈⋅*ABppχΔ=⋅b...