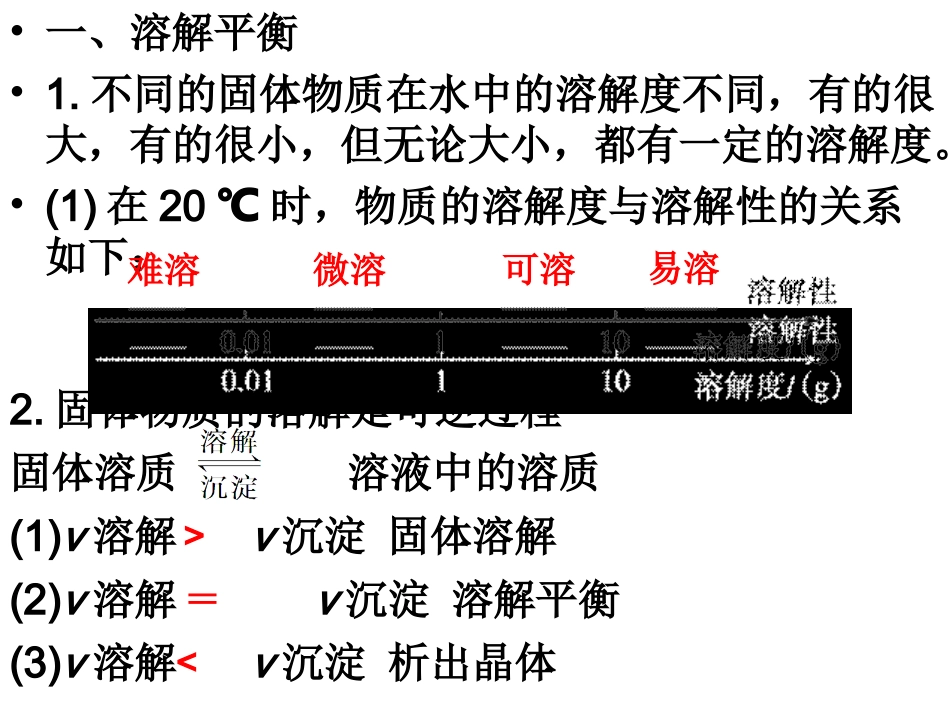
第四节难溶电解质的溶解平衡第四节难溶电解质的溶解平衡第三章水溶液中的离子平衡•一、溶解平衡•1.不同的固体物质在水中的溶解度不同,有的很大,有的很小,但无论大小,都有一定的溶解度。•(1)在20℃时,物质的溶解度与溶解性的关系如下:难溶微溶可溶易溶2.固体物质的溶解是可逆过程固体溶质溶液中的溶质(1)v溶解v沉淀固体溶解(2)v溶解v沉淀溶解平衡(3)v溶解v沉淀析出晶体>=<•3.在一定温度下,当沉淀溶解和生成的速率相等时,即建立了动态平衡,叫做沉淀溶解平衡。如AgCl溶于水有AgCl(s)Ag+(aq)+Cl-(aq)。•沉淀溶解平衡状态的特征•(1)动态平衡v溶解=v沉淀≠0。•(2)达到平衡时,溶液中离子的浓度保持不变。•(3)当改变外界条件时溶解平衡将发生移动达到新的平衡•二、影响沉淀溶解平衡的因素•1.在装有少量难溶的PbI2黄色固体的试管中,加入约3mL蒸馏水,充分振荡后静置。•(1)若在上层清液中滴加浓的KI溶液,观察到的现象是上层清液中出现黄色沉淀2.难溶物质溶解程度的大小,主要取决于物质本身的性质。但改变外界条件(如浓度、温度等),沉淀溶解平衡会发生移动。2)由上述实验得出的结论是原上层清液中含有Pb2+,PbI2在水中存在溶解平衡(3)PbI2溶于水的平衡方程式是PbI2(s)Pb2+(aq)+2I-(aq)条件改变移动方向c(Mg2+)c(OH-)加水升温加MgCl2(s)加盐酸加NaOH(s)已知溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该溶解平衡的影响,填写下表:正向移动减小减小正向移动增大增大逆向移动增大减小正向移动增大减小逆向移动减小增大[总结]外界条件改变对溶解平衡的影响(1)温度升高,多数溶解平衡向溶解的方向移动。(2)加水稀释,浓度减小,溶解平衡向溶解方向移动。(3)加入与难溶电解质构成微粒相同的物质,溶解平衡向生成沉淀的方向移动。(4)加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。[例1]把氢氧化钙放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),加入以下溶液,可使Ca(OH)2减少的是A.Na2CO3溶液B.AlCl3溶液C.NaOH溶液D.CaCl2溶液AB[例2]将AgCl分别投入下列溶液中:①40mL0.03mol·L-1的HCl溶液②50mL0.05mol·L-1的AgNO3溶液③30mL0.02mol·L-1的CaCl2溶液④10mL蒸馏水AgCl的溶解度由大到小的顺序是。三、溶度积常数1.在一定温度下,沉淀达溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示.④①②③>>>2.写出下列沉淀溶解平衡的溶度积常数的表达式(1)AgCl(s)Ag+(aq)+Cl-(aq)(2)Fe(OH)3(s)Fe3+(aq)+3OH-(aq)(3)AmBn(s)mAn+(aq)+nBm-(aq)3.通过比较溶度积与离子积Qc的相对大小,可以判断难溶电解质在给定条件下平衡进行方向:(1)Qc>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。(2)Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状。(3)QcKsp,c(Ba2+)=c(SO42-)C.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-)D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)