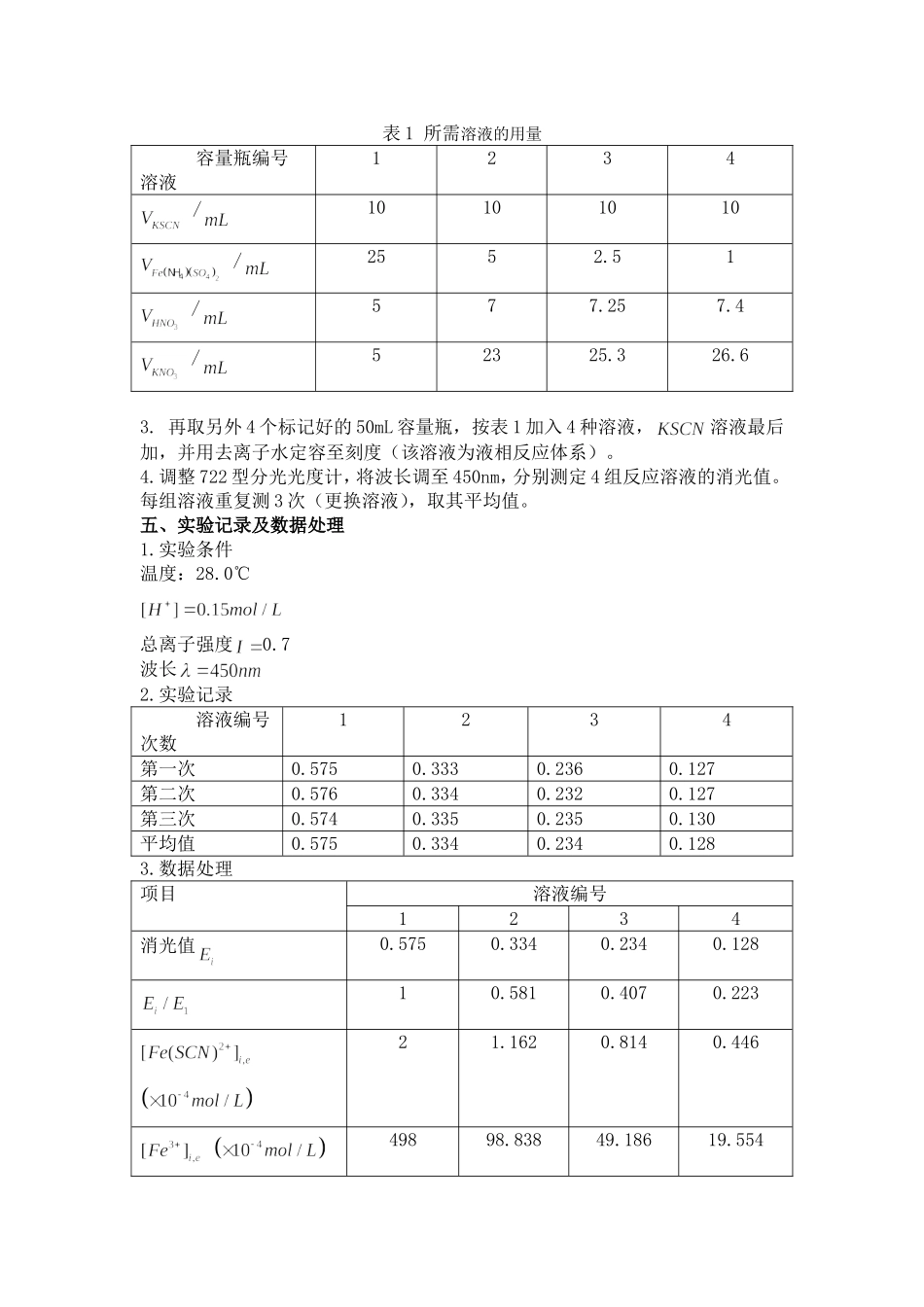
液相反应平衡常数的测定学生姓名:大芒果学生学号:学生专业:化学教育年级班级:2014级指导老师:林晓明实验时间:2016.11.21一、实验目的(1)利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子液相反应的平衡常数。(2)通过实验了解热力学平衡常数与反应物的起始浓度无关。二、实验原理与在溶液中可生成一系列络离子,并共存于同一个平衡体系中。当的浓度增加时,与生成的络合物的组成发生如下的改变,而这些不同的络离子的溶液颜色也不同。当与浓度很低的(一般应小于)只进行如下反应。即反应被控制在仅仅生成最简单的。其平衡常数为由于是带有颜色的,根据朗伯-比尔定律,消光值与溶液浓度成正比,实验时,只要在一定条件下,借助分光光度计测定平衡体系的消光值,从而计算出平衡时的的浓度,进而再推算出平衡时和的浓度和,进而再推算一定温度下反应的平衡常数。实验时配制若干组(共4组)不同起始浓度的反应溶液,其中第一组溶液的是大量的,当用分光光度计测定反应液在定温下消光值(为组数),根据朗伯-比尔定律由于1号溶液中大量过量,平衡时全部与络合(下标0表示起始浓度),对1号溶液可认为则对于其余组溶液,两式相除并整理得达到平衡时,在体系中将、、代入,则可计算出除第1组外各组(不同起始浓度)反应溶液在定温下的平衡常数值三、仪器与试剂(1)实验仪器722型分光光度计1台50mL容量瓶8个刻度移液管10mL(2支)、5mL(1支)25mL移液管(1支)50mL酸式滴定管1支洗耳球、洗瓶(2)实验试剂四、实验步骤1.取8个50mL容量瓶,贴上标签。2.取4个标记好的50mL容量瓶,按表1加入除溶液外的3种溶液(注意:在这4个容量瓶中,溶液的氢离子均为0.15,用来调节;溶液的离子强度均为0.7,用来调节),并用去离子水定容至刻度(该溶液为测消光值的对比液)。表1所需溶液的用量容量瓶编号溶液1234/10101010/2552.51/577.257.4/52325.326.63.再取另外4个标记好的50mL容量瓶,按表1加入4种溶液,溶液最后加,并用去离子水定容至刻度(该溶液为液相反应体系)。4.调整722型分光光度计,将波长调至450nm,分别测定4组反应溶液的消光值。每组溶液重复测3次(更换溶液),取其平均值。五、实验记录及数据处理1.实验条件温度:28.0℃总离子强度0.7波长2.实验记录溶液编号次数1234第一次0.5750.3330.2360.127第二次0.5760.3340.2320.127第三次0.5740.3350.2350.130平均值0.5750.3340.2340.1283.数据处理项目溶液编号1234消光值0.5750.3340.2340.12810.5810.4070.22321.1620.8140.44649898.83849.18619.55400.8381.1861.554140.3139.5146.8平均值142.2相对误差1.34%1.90%3.23%4.结果与讨论根据文献1得25℃的Kc为143.7,15℃时的Kc为157.4,∆H=-1.541kJ/mol。因为∆H<0,所以该反应为放热反应,随着温度升高,Kc下降,故Kc应小于143.7。本次实验中室温为28.0℃,测得Kc平均值为142.2<143.7,相对合理。数据的相对误差也较小,因此本次实验的精密度较好,数据相对可靠。但第四组测得的Kc>143.7,可能的原因是本次实验没有条件控制恒温,在做实验的过程中,实验温度有波动,可能测第四组时实验温度低于25℃。本次实验中可能存在的其他误差如下:①可能比色皿放入比色槽之前用擦镜纸擦镜面时没有擦干净,导致吸光度不准确;②可能移取溶液的体积存在误差,导致各物质的浓度不准确;③人为的偶然误差。六、实验注意事项1.使用分光光度计时,先接通电源,预热20min,为了延长光电管的寿命,在不测定数值时,应盖上暗箱。2.反应体系中各组分的浓度配制和取量必须准确,取溶液时移液管不能混用;。3.比色皿放入比色槽之前一定要用擦镜纸将镜面擦干净。仪器所配套的比色皿不能单个与其他仪器上的比色皿调换、比色皿内所装溶液应低于皿口0.5-1cm。4.测量完毕后,取出比色皿洗净,放好,先关仪器电源开关,再切断电源。七、提问与思考1.当与浓度较大时,能否再用计算络离子生成的平衡常数?答:不可以。当与浓度很低的(一般应小于)混合,只进行如下反应,即反应被控制在仅仅生成最简单的,此时才可以用计算。当与浓度较大时,,则,不再成立。2.平衡常数与反应物起始浓度有无...