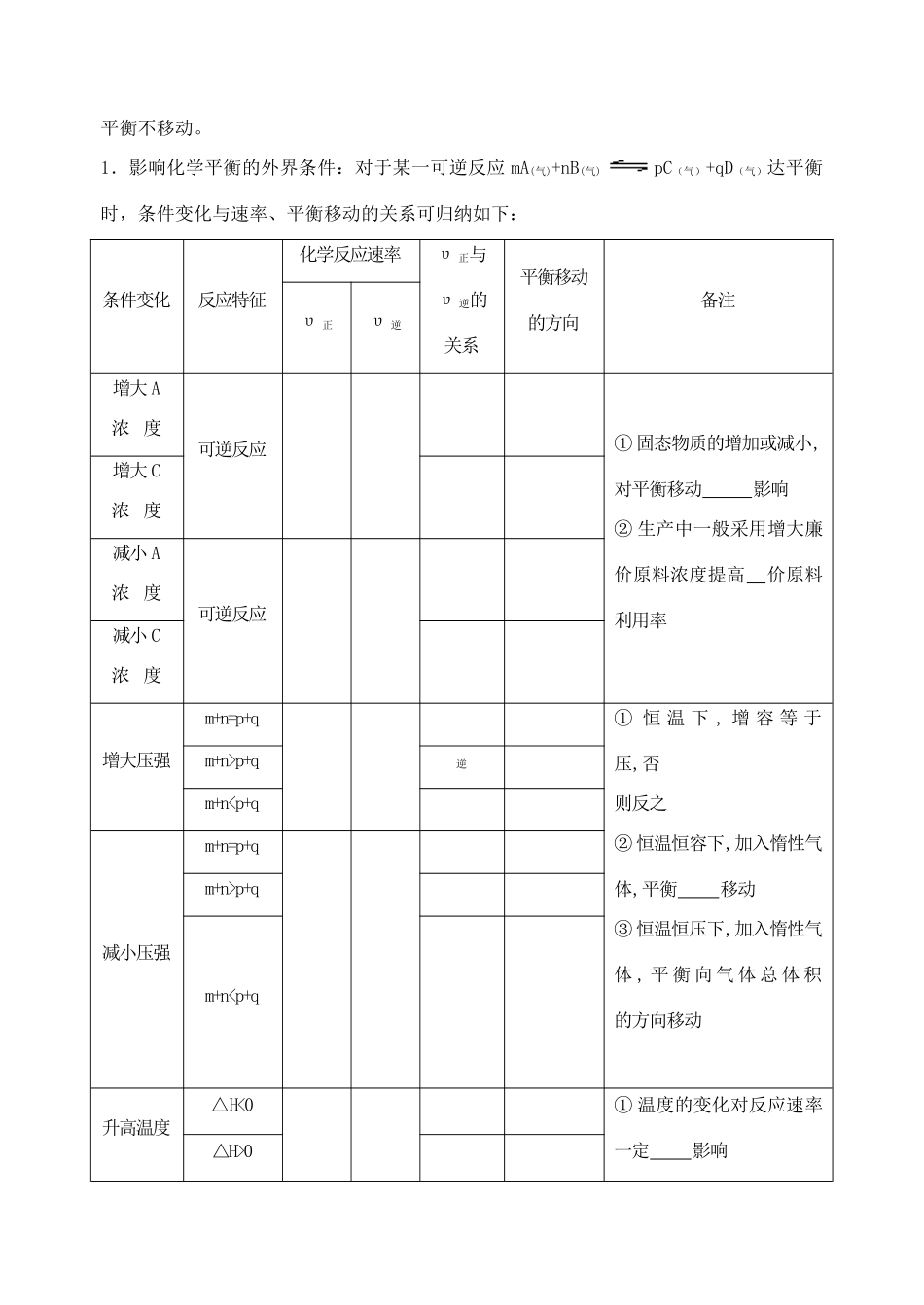
第十五讲化学平衡及其影响因素(第一课时)一、要点精讲1、可逆反应的反应。如:。不可逆反应的反应。如:1.化学平衡的研究对象是2.化学平衡状态化学平衡状态特征有4.可逆反应到达平衡状态的标志⑴本质标志通常有三种:①②③⑵其他标志:①各组分的物质的量、、不随时间的改变而改变;②对于有颜色气体参加的反应,混合气体不随时间改变而改变;③恒温、恒容时,对于反应前后气体总体积不等的反应,不再改变、混合气体的不再改变;④恒温、恒压时,对于反应前后气体总体积不等的反应,不再改变、混合气体的不再改变;⑤对于吸热或放热反应,绝热体系的不随时间的改变而改变;等等。5.化学平衡的移动:已达平衡的可逆反应,由于的改变,原平衡被,各组成,使其在恒定的情况下建立起。这种由原条件下的向新条件下的的转化过程,称为化学平衡的移动。⑴导致化学平衡移动的原因:。⑵平衡移动方向的判断:①外界条件改变导致,原平衡正向移动;②外界条件改变导致,原平衡逆向移动;③外界条件改变导致v(正)、v(逆)变化,但变化的,变化过程中始终保持,平衡不移动。1.影响化学平衡的外界条件:对于某一可逆反应mA(气)+nB(气)pC(气)+qD(气)达平衡时,条件变化与速率、平衡移动的关系可归纳如下:条件变化反应特征化学反应速率υ正与υ逆的关系平衡移动的方向备注υ正υ逆增大A浓度可逆反应①固态物质的增加或减小,对平衡移动影响②生产中一般采用增大廉价原料浓度提高价原料利用率增大C浓度减小A浓度可逆反应减小C浓度增大压强m+n=p+q①恒温下,增容等于压,否则反之②恒温恒容下,加入惰性气体,平衡移动③恒温恒压下,加入惰性气体,平衡向气体总体积的方向移动m+n>p+q逆m+n
p+qm+n0②改变温度,反应物的转化率一定升高(或降低),生成物的含量增大(或降降低温度△H<0△H>0正催化剂任何反应使用催化剂使化学平衡发生移动,但可到达平衡的时间负催化剂7.勒沙特列原理:二、典型例题【例1】在一定温度下,反应A2(g)+B2(g)2AB(g)达到平衡的标志是()【答案】CA.单位时间内生成nmol的A2同时生成nmolAB。B.容器内的总压强不随时间变化C.单位时间内生成2nmol的AB,同时生成nmol的B2。D.单位时间内生成nmolA2同时生成nmolB2。A.②⑤⑦B.①③④⑥⑧C.只有③D.只有⑤【例2】(06盐城三模)甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2CH3OH,工艺中一些参数如下图;目前正在开发的新法2CH4+O22CH3OH,下列有关新法和旧法的说法正确的是ACA.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应B.旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势C.新法与旧法相比,原料丰富并可直接从天然气中获得D.新法生产中,需控制V(CH4)/V(O2)=9︰1,目的是提高空气中氧气的转化率【例3】100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是:①烧瓶内气体的颜色不再加深,②N2O4的消耗速率与NO2的生成速率之比为1∶2,③NO2的生成速率与NO2消耗速率相等,④NO2的物质的量浓度不变,⑤烧瓶内气体的质量不再变化,⑥烧瓶内气体的压强不再变化,⑦烧瓶内气体的密度不再变化,⑧烧瓶内气体的平均相对分子质量不再变化。A.②⑤⑦B.①③④⑥⑧C.只有③D.只有⑤【例4】化工生产在遵循科学原理、实现某个化学反应的基础上,必须考虑综合经济效益,最大限度的降低成本,提高劳动生产率,保护生态环境。以下是对合成氨工业和硫酸工业的综合经济效益的考虑:①合成氨工业应采用尽可能高的压强以提高反应物的转化率,②考虑到反应速率和催化剂的催化活性,合成氨反应和二氧化硫的催化氧化一般都选择在500℃左右的温度下进行,③合成氨工业中从平衡混合物里分离出的氮气和氢气应循环使用,④合成氨工业中的原料气之一氢气常采用电解水的方法制取,⑤两工业中均应考虑充分利用反应本身放...