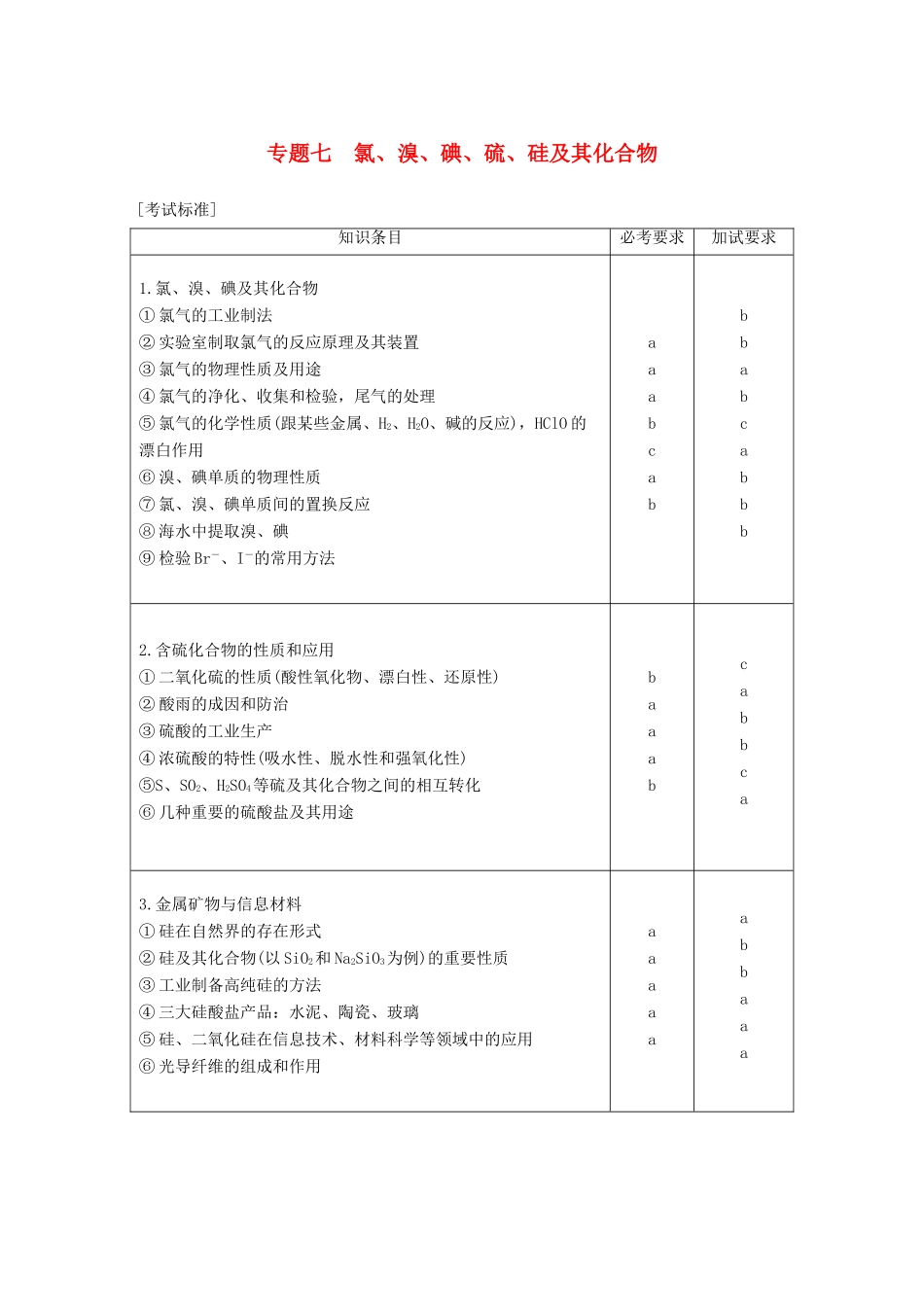
专题七氯、溴、碘、硫、硅及其化合物[考试标准]知识条目必考要求加试要求1.氯、溴、碘及其化合物①氯气的工业制法②实验室制取氯气的反应原理及其装置③氯气的物理性质及用途④氯气的净化、收集和检验,尾气的处理⑤氯气的化学性质(跟某些金属、H2、H2O、碱的反应),HClO的漂白作用⑥溴、碘单质的物理性质⑦氯、溴、碘单质间的置换反应⑧海水中提取溴、碘⑨检验Br-、I-的常用方法aaabcabbbabcabbb2.含硫化合物的性质和应用①二氧化硫的性质(酸性氧化物、漂白性、还原性)②酸雨的成因和防治③硫酸的工业生产④浓硫酸的特性(吸水性、脱水性和强氧化性)⑤S、SO2、H2SO4等硫及其化合物之间的相互转化⑥几种重要的硫酸盐及其用途baaabcabbca3.金属矿物与信息材料①硅在自然界的存在形式②硅及其化合物(以SiO2和Na2SiO3为例)的重要性质③工业制备高纯硅的方法④三大硅酸盐产品:水泥、陶瓷、玻璃⑤硅、二氧化硅在信息技术、材料科学等领域中的应用⑥光导纤维的组成和作用aaaaaabbaaa考点一氯、溴、碘及其化合物1.树立物质转化思想(1)理清知识主线HCl―→Cl2―→HClO―→HClO2―→HClO3―→HClO4(2)形成网络构建2.扫除易忘知识盲点(1)液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。(2)1molCl2参加反应,转移电子数可能为2NA、NA或小于NA(Cl2和H2O的反应为可逆反应)。(3)实验室制Cl2,除了用MnO2和浓盐酸反应外,还可以用KMnO4、KClO3、NaClO与浓盐酸反应且都不需要加热,如ClO-+Cl-+2H+===Cl2↑+H2O。(4)酸性KMnO4溶液,用的是H2SO4酸化而不是盐酸。(5)ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与SO、I-、Fe2+均不能大量共存;ClO-体现水解性,因HClO酸性很弱,ClO-水解显碱性,如Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以ClO-与Fe3+、Al3+均不能大量共存。(6)向Ca(ClO)2溶液中通入SO2气体生成CaSO4而不是CaSO3,其离子方程式为Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO(少量SO2),Ca2++2ClO-+2SO2+2H2O===CaSO4↓+2Cl-+SO+4H+(过量SO2)。(7)当Fe和Cl2在点燃条件下反应时,不论Fe过量或不足,由于Cl2的强氧化性,产物一定是FeCl3。(8)“84”消毒液的主要成分为NaClO,漂白粉的有效成分为Ca(ClO)2。“84”消毒液和洁厕灵不能混合使用,其原因是ClO-+Cl-+2H+===Cl2↑+H2O。(9)液溴需要用水封,溴蒸气呈红棕色,液溴呈深红棕色,溴水呈橙色,溴的CCl4溶液呈橙红色。3.规范书写重要反应用方程式回答下列问题。(1)实验室用MnO2和浓盐酸反应制取Cl2的化学方程式。MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O。(2)将浓盐酸滴到KMnO4固体上(用离子方程式表示)。2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。(3)将Cl2通入石灰乳中(用化学方程式表示)。2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。(4)在空气中漂白粉漂白的原理。Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO。(5)向FeBr2溶液中通入少量Cl2的离子方程式。2Fe2++Cl2===2Fe3++2Cl-。(6)向FeBr2溶液中通入等物质的量Cl2的离子方程式。2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-。(7)向FeBr2溶液中通入过量Cl2的离子方程式。2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。(8)将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。SO2+Cl2+2H2O===4H++SO+2Cl-。题组一氯气的性质及氯水性质的多样性1.(2017·宁波市北仑中学高一上学期期中)下列叙述不正确的是()A.氯水能够使石蕊溶液变红后褪色,说明氯水中存在H+和漂白性物质B.向上排空气法收集氯气可以用湿润的KI淀粉试纸是否变蓝检验是否收集满C.氯水与氯化铁在自来水处理的过程中原理是不同的D.实验室应用无色细口玻璃试剂瓶存放保存在煤油中的钠答案D2.(2017·台州市高一上学期期末质量评估)下列说法不正确的是()A.液氯可存储于钢瓶中运输和使用B.氯水呈黄绿色,说明氯水中含有Cl2C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向新制氯水中滴加少量紫色石蕊溶液,充分振荡后溶液呈红色答案D解析A项,液氯不与铁反应,所以液氯可存储于钢瓶中运输和使用,正确;B项,氯气...