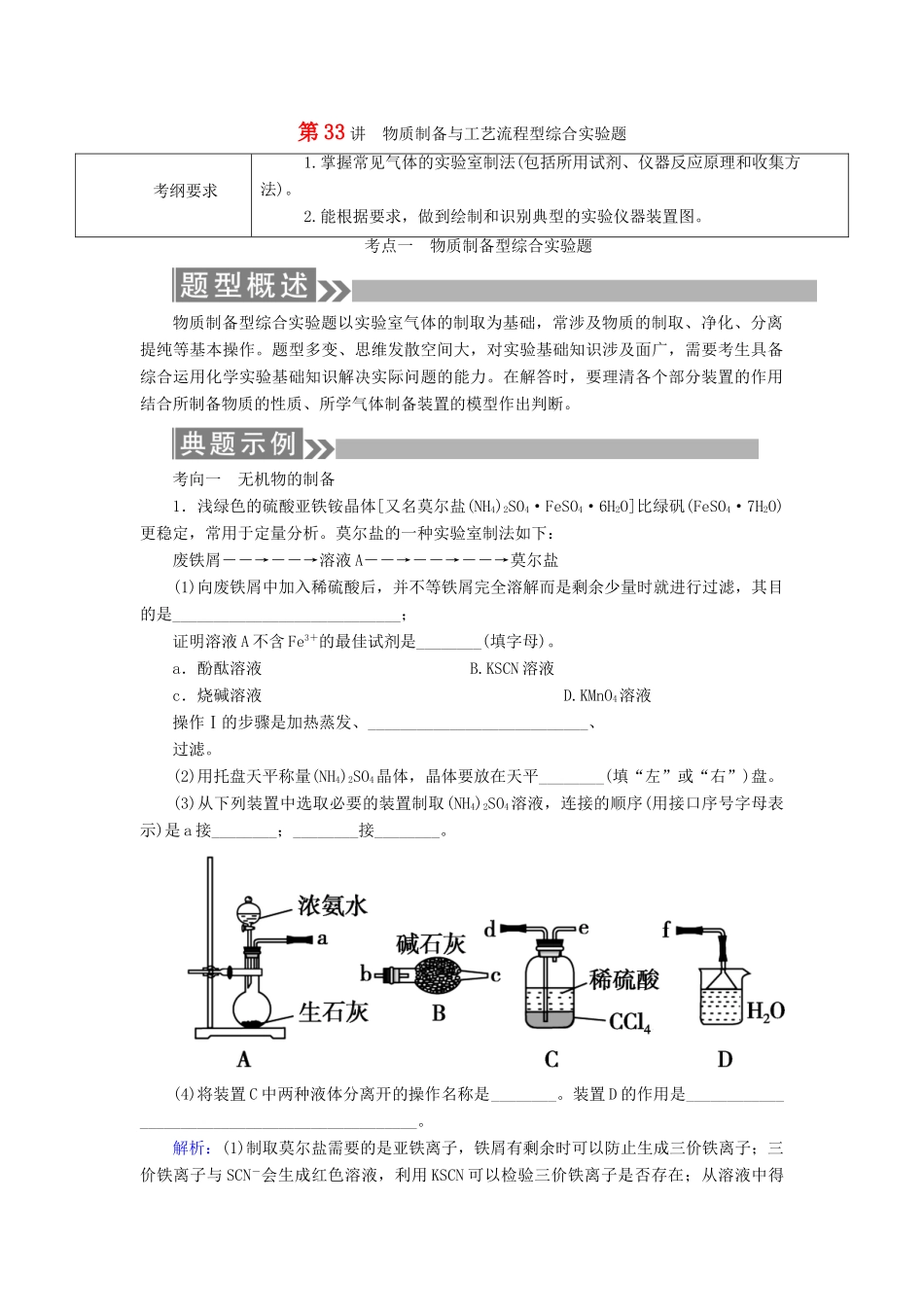
第33讲物质制备与工艺流程型综合实验题考纲要求1.掌握常见气体的实验室制法(包括所用试剂、仪器反应原理和收集方法)。2.能根据要求,做到绘制和识别典型的实验仪器装置图。考点一物质制备型综合实验题物质制备型综合实验题以实验室气体的制取为基础,常涉及物质的制取、净化、分离提纯等基本操作。题型多变、思维发散空间大,对实验基础知识涉及面广,需要考生具备综合运用化学实验基础知识解决实际问题的能力。在解答时,要理清各个部分装置的作用结合所制备物质的性质、所学气体制备装置的模型作出判断。考向一无机物的制备1.浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:废铁屑――→――→溶液A――→――→――→莫尔盐(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是____________________________;证明溶液A不含Fe3+的最佳试剂是________(填字母)。a.酚酞溶液B.KSCN溶液c.烧碱溶液D.KMnO4溶液操作Ⅰ的步骤是加热蒸发、___________________________、过滤。(2)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平________(填“左”或“右”)盘。(3)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是a接________;________接________。(4)将装置C中两种液体分离开的操作名称是________。装置D的作用是______________________________________________。解析:(1)制取莫尔盐需要的是亚铁离子,铁屑有剩余时可以防止生成三价铁离子;三价铁离子与SCN-会生成红色溶液,利用KSCN可以检验三价铁离子是否存在;从溶液中得到晶体,需要加热蒸发、冷却结晶。(2)用托盘天平称量物质应遵循“左物右码”原则。(3)氨气与稀硫酸反应制取(NH4)2SO4,氨气不需要干燥,故不需要B装置。(4)分离密度不同且互不相溶的液体采用分液操作,为防止污染空气,过量的氨气要用水吸收,倒置的漏斗可防止倒吸。答案:(1)防止Fe2+被氧化为Fe3+(其他合理答案也可)b冷却结晶(2)左(3)def(4)分液吸收多余的NH3防止污染空气,防止倒吸【技法归纳】制备装置图的分析方法(1)明确目的,对欲制备物质的性质有所了解,如状态(气、液、固)、熔沸点等。(2)所制备的物质有无特殊性质,如还原性、毒性、是否需要特殊保护等。(3)每一个装置进入的物质是什么?吸收了或生成了何种物质?2.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。(1)实验室利用反应TiO2(s)+CCl4(g)=====TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:有关物质性质如下表:物质熔点/℃沸点/℃其他CCl4-2376与TiCl4互溶TiCl4-25136遇潮湿空气产生白雾仪器A的名称是________,装置E中的试剂是______________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2②熄灭酒精灯③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________________。(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:酸溶FeTiO3(s)+2H2SO4(aq)===FeSO4(aq)+TiOSO4(aq)+2H2O(l)水解TiOSO4(aq)+2H2O(l)=====H2TiO3(s)+H2SO4(aq)简要工艺流程如下:①试剂A为________。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品TiO2收率降低,原因是_____________________。②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是________(填化学式)。解析:(1)“无水无氧”条件下制备实验,产品TiCl4遇潮湿空气产生白雾,因此体系始终都要隔离空气、水分,A是干燥管,使用固体干燥剂,E中盛放浓H2SO4,反应开始,先组装装置,检查气密性再装药品,反应结束后先熄灭酒精灯,持续通N2至冷却,防止空气中O2乘隙而入,D中的液态混合物为互溶的CCl4和TiCl4,两者沸点差别较大,采用蒸馏方法分离。...