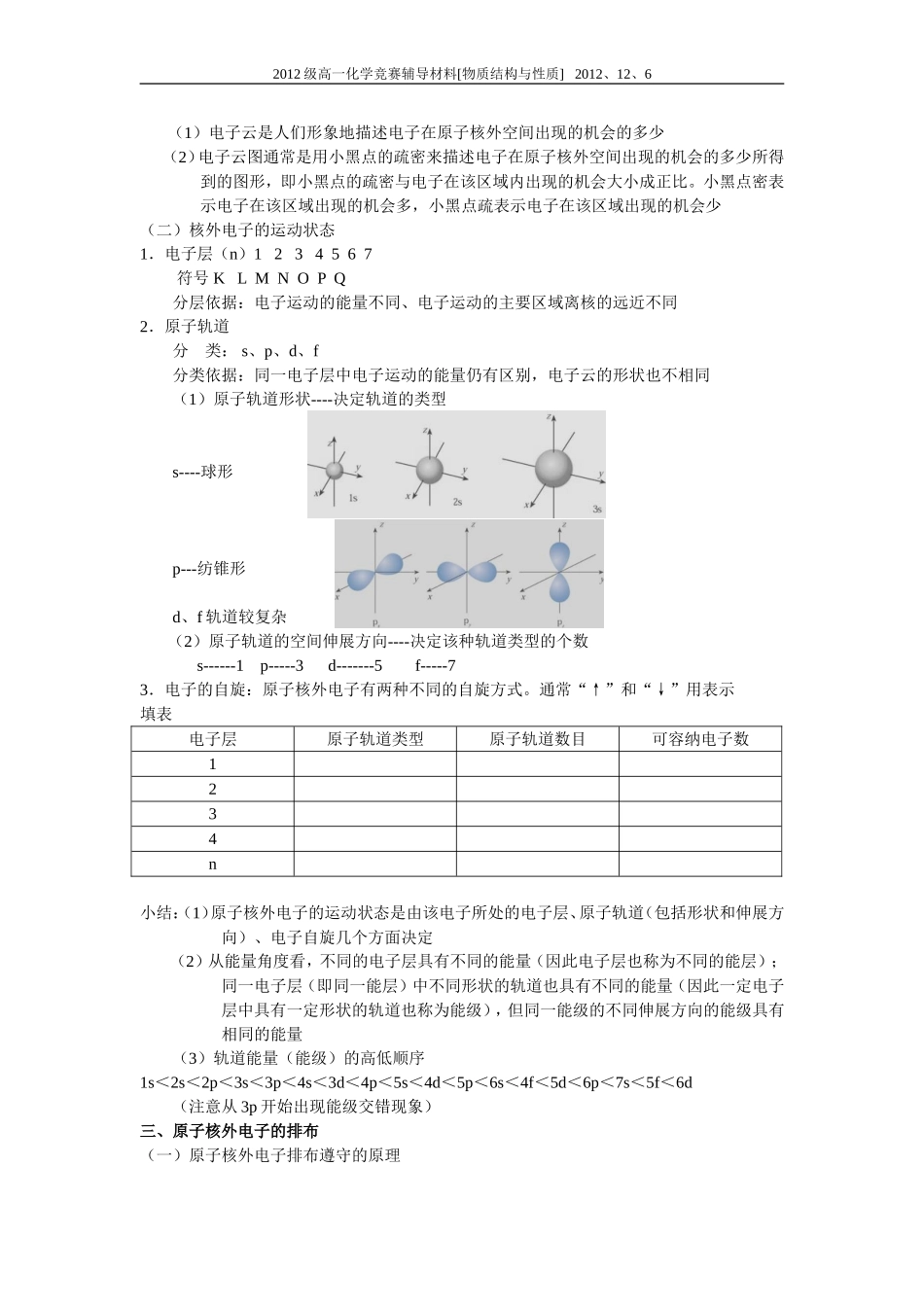
2012级高一化学竞赛辅导材料[物质结构与性质]2012、12、6第二讲原子核外电子的运动一、学习目标:1、认识原子结构核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。2、了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见的元素(1~36)原子核外电子的排布。二、教学内容:一、人类探索物质结构的历史(一)1.人类探索原子结构的历史(1)公元前5世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子。(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为:物质由原子组成,原子不能被创造也不能被毁灭,在化学变化中原子不可再分割,它们的化学性质在化学反应中保持不变。(3)原子分子论的创立1811年,阿伏加德罗提出了分子的概念,他认为气体分子是由几个原子构成的.1860年,国际化学界确立了原子分子论.2、原子结构模型的演变3.元素周期表的发现1869年,已有63种元素为科学家所认识,门捷列夫将各元素按原子量的变化联系起来,揭示了自然界的一条基本规律---元素周期律。4.对有机物认识的进展碳原子的四价,有机物碳原子成键的立体结构,有机物分子中键的饱和性等相继被发现5.物理学上的重大发现19世纪末20世纪初,量子力学(微观粒子具有波粒二象性)确立。量子力学是研究原子和分子结构的理论基础6.实验方法上的改进光谱、衍射等新方法应用于研究原子、分子和晶体结构(二)原子结构模型的演变(1)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。(2)1897年,英国科学家汤姆生发现了电子。1904年提出“葡萄干面包式”的原子结构模型(3)1911年英国物理学家卢瑟福(汤姆生的学生)提出了带核的原子结构模型,他被称为“原子之父”(4)1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型。(5)奥地利物理学家薛定谔提出电子云模型(几率说)二、原子核外电子的运动(一)原子核外电子的运动特点1.原子核外电子以极高的速度、在极小的空间内作永不停止的运动。2.核外电子的运动不遵循宏观物体所具有的运动规律(不能测出在某一时刻的位置、速度,即不能描画出它的运动轨迹)。描述核外电子运动通常采用统计的方法---电子云*对“电子云”图的认识:2012级高一化学竞赛辅导材料[物质结构与性质]2012、12、6(1)电子云是人们形象地描述电子在原子核外空间出现的机会的多少(2)电子云图通常是用小黑点的疏密来描述电子在原子核外空间出现的机会的多少所得到的图形,即小黑点的疏密与电子在该区域内出现的机会大小成正比。小黑点密表示电子在该区域出现的机会多,小黑点疏表示电子在该区域出现的机会少(二)核外电子的运动状态1.电子层(n)1234567符号KLMNOPQ分层依据:电子运动的能量不同、电子运动的主要区域离核的远近不同2.原子轨道分类:s、p、d、f分类依据:同一电子层中电子运动的能量仍有区别,电子云的形状也不相同(1)原子轨道形状----决定轨道的类型s----球形p---纺锥形d、f轨道较复杂(2)原子轨道的空间伸展方向----决定该种轨道类型的个数s------1p-----3d-------5f-----73.电子的自旋:原子核外电子有两种不同的自旋方式。通常“↑”和“↓”用表示填表电子层原子轨道类型原子轨道数目可容纳电子数1234n小结:(1)原子核外电子的运动状态是由该电子所处的电子层、原子轨道(包括形状和伸展方向)、电子自旋几个方面决定(2)从能量角度看,不同的电子层具有不同的能量(因此电子层也称为不同的能层);同一电子层(即同一能层)中不同形状的轨道也具有不同的能量(因此一定电子层中具有一定形状的轨道也称为能级),但同一能级的不同伸展方向的能级具有相同的能量(3)轨道能量(能级)的高低顺序1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d(注意从3p开始出现能级交错现象)三、原子核外电子的排布(一)原子核外电子排布遵守的原理2012级高一化学竞赛辅导材料[物质结构与性质]2012、12、61.能量最低原理:原子核外电子尽先占有能量最低的轨道(...