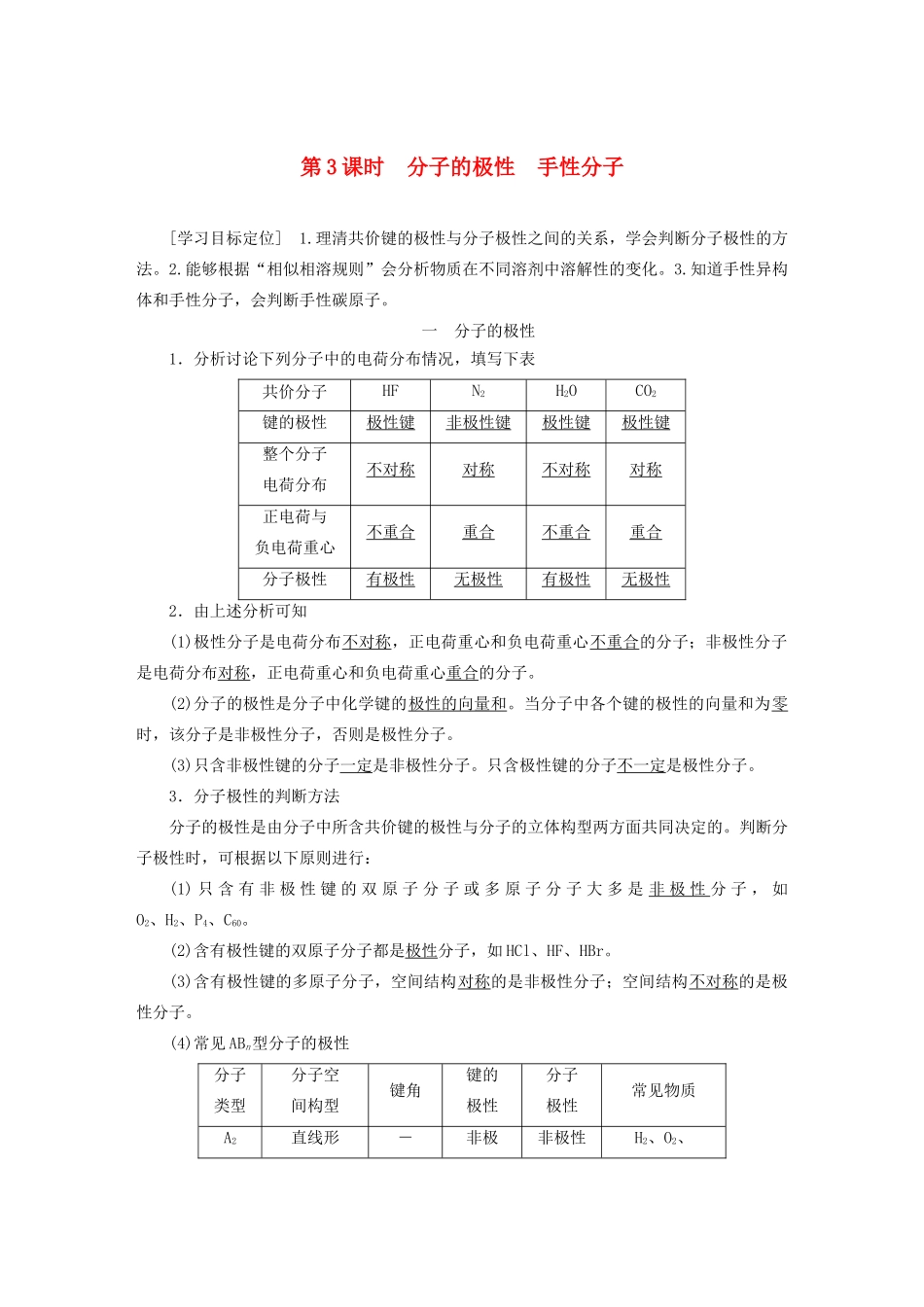
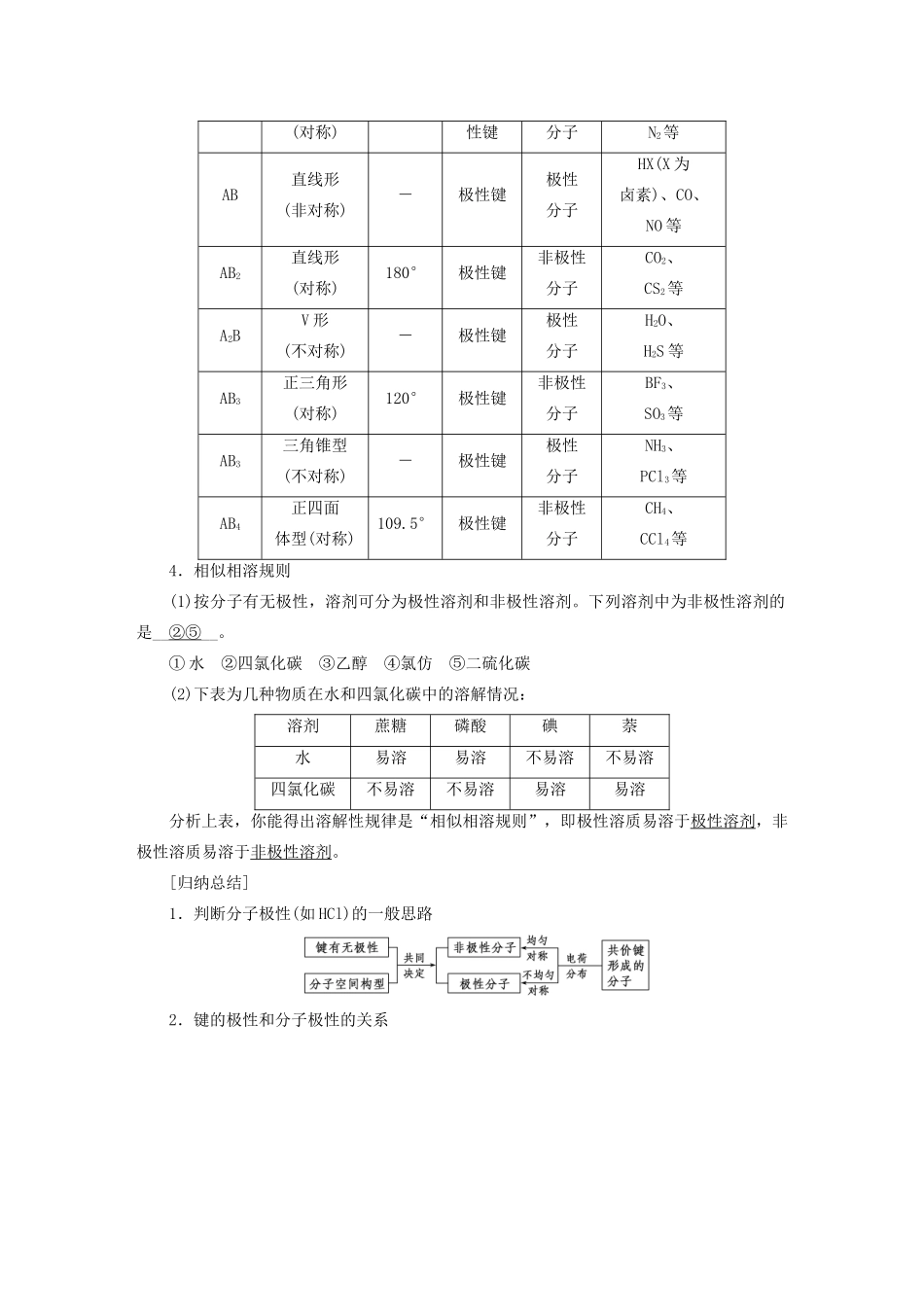
第3课时分子的极性手性分子[学习目标定位]1.理清共价键的极性与分子极性之间的关系,学会判断分子极性的方法。2.能够根据“相似相溶规则”会分析物质在不同溶剂中溶解性的变化。3.知道手性异构体和手性分子,会判断手性碳原子。一分子的极性1.分析讨论下列分子中的电荷分布情况,填写下表共价分子HFN2H2OCO2键的极性极性键非极性键极性键极性键整个分子电荷分布不对称对称不对称对称正电荷与负电荷重心不重合重合不重合重合分子极性有极性无极性有极性无极性2.由上述分析可知(1)极性分子是电荷分布不对称,正电荷重心和负电荷重心不重合的分子;非极性分子是电荷分布对称,正电荷重心和负电荷重心重合的分子。(2)分子的极性是分子中化学键的极性的向量和。当分子中各个键的极性的向量和为零时,该分子是非极性分子,否则是极性分子。(3)只含非极性键的分子一定是非极性分子。只含极性键的分子不一定是极性分子。3.分子极性的判断方法分子的极性是由分子中所含共价键的极性与分子的立体构型两方面共同决定的。判断分子极性时,可根据以下原则进行:(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子,如O2、H2、P4、C60。(2)含有极性键的双原子分子都是极性分子,如HCl、HF、HBr。(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。(4)常见ABn型分子的极性分子类型分子空间构型键角键的极性分子极性常见物质A2直线形-非极非极性H2、O2、(对称)性键分子N2等AB直线形(非对称)-极性键极性分子HX(X为卤素)、CO、NO等AB2直线形(对称)180°极性键非极性分子CO2、CS2等A2BV形(不对称)-极性键极性分子H2O、H2S等AB3正三角形(对称)120°极性键非极性分子BF3、SO3等AB3三角锥型(不对称)-极性键极性分子NH3、PCl3等AB4正四面体型(对称)109.5°极性键非极性分子CH4、CCl4等4.相似相溶规则(1)按分子有无极性,溶剂可分为极性溶剂和非极性溶剂。下列溶剂中为非极性溶剂的是__②⑤__。①水②四氯化碳③乙醇④氯仿⑤二硫化碳(2)下表为几种物质在水和四氯化碳中的溶解情况:溶剂蔗糖磷酸碘萘水易溶易溶不易溶不易溶四氯化碳不易溶不易溶易溶易溶分析上表,你能得出溶解性规律是“相似相溶规则”,即极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。[归纳总结]1.判断分子极性(如HCl)的一般思路2.键的极性和分子极性的关系[活学活用]1.下列各组分子中,都属于含极性键的非极性分子的是()A.CO2、H2SB.C2H4、CH4C.Cl2、C2H2D.NH3、HCl答案B解析A项中CO2和H2S都含极性键,但前者是非极性分子(直线形),后者是极性分子(V形);B项中C2H4是平面分子,CH4为正四面体型,均含极性键且均为非极性分子;C项中Cl2不含极性键;D项中NH3、HCl均为极性分子。二手性分子1.观察比较下图所示两种分子的结构(1)相同点是分子组成相同,都是CHFClBr;从平面上看相似。(2)不同点是在空间上完全不同,它们构成实物和镜像关系。(3)具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称为手性异构体。有手性异构体的分子叫做手性分子。2.手性分子的判断判断一种有机物是否具有手性异构体,关键是看其含有的碳原子是否连有4个不同的原子或基团,即有机物分子中是否存在手性碳原子。如,R1、R2、R3、R4互不相同,含有手性碳原子,该有机物分子具有手性。[归纳总结]1.手性同分异构体(又称对映异构体、光学异构体)的两个分子互为镜像关系,即分子形式的“左撇子和右撇子”。2.构成生命体的有机物绝大多数为手性分子。两个手性分子的性质不同,且手性有机物中必定含手性碳原子。[活学活用]2.下列化合物中含有手性碳原子的是()A.CCl2F2B.CH3CH2OH答案D解析中心原子连有四个不同的原子或基团,化合物的分子才具有手性。A中C原子只连有Cl、F两种原子,故A项错误;分子中两个C原子分别连有2种和3种不同的原子或基团,故B项错误;分子中1、3号C原子结构对称,故2号C原子连有3种原子或基团,1、3号C原子相同,连有2个氢原子,即连有3种不同原子或基团,故C项错误;分子中2号C原子连有—CH3、—H、—COOH、—OH四...