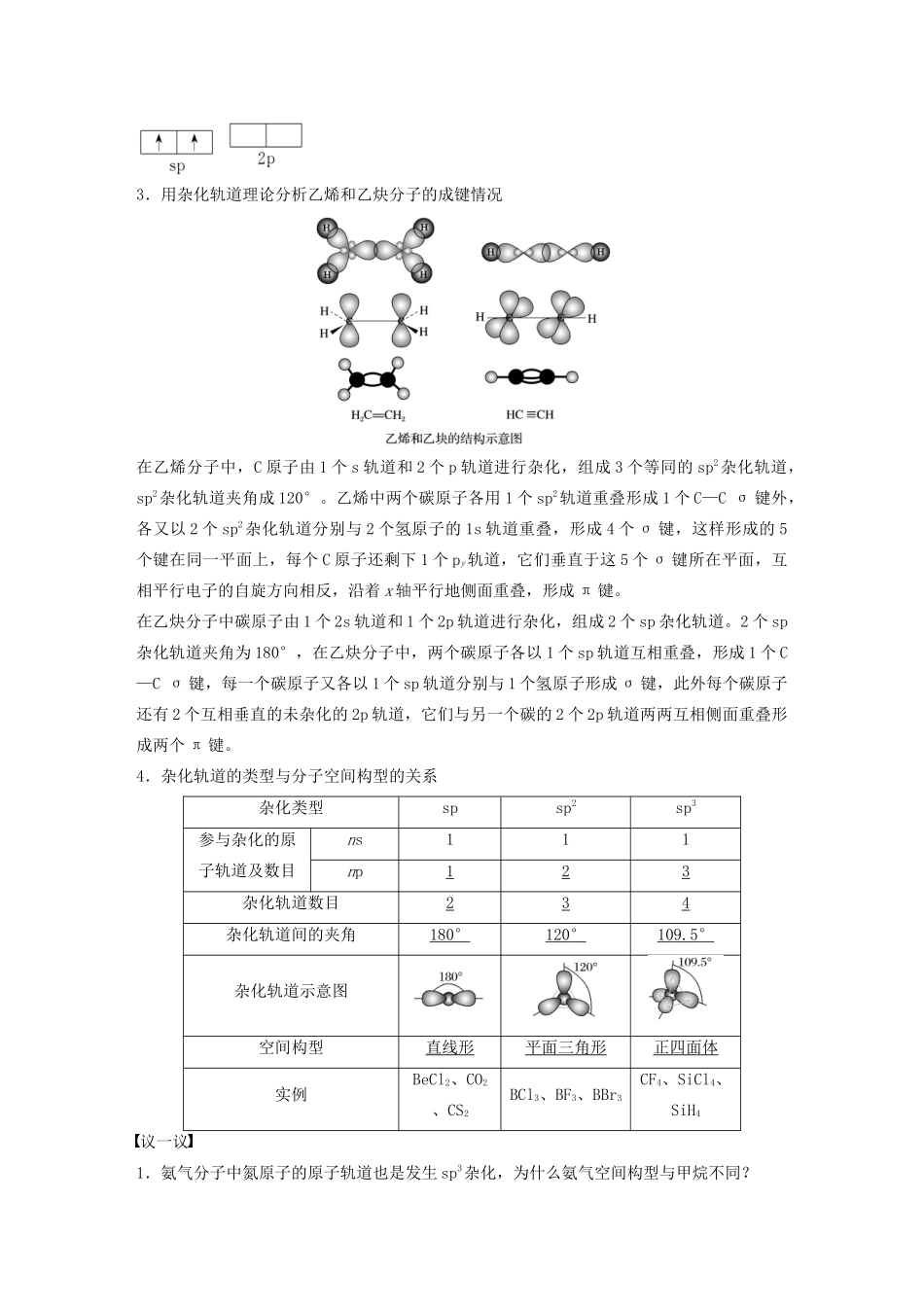
第1课时分子的空间构型[目标导航]1.能用杂化轨道理论、价层电子对互斥模型及等电子原理解释或预测一些分子或离子的空间构型。2.知道一些常见简单分子的空间构型(如甲烷、氨分子、苯、乙烯等)。一、杂化轨道理论1.用杂化轨道理论解释甲烷分子的形成及结构根据杂化轨道理论,C原子是CH4分子的中心原子,其基态外围电子排布为2s22p2p2p,在形成CH4分子的过程中,C原子的1个2s电子激发到2p空轨道,只有一个未成对电子的2s轨道与3个均含有未成对电子的2p轨道混合起来,形成能量相等,成分相同的4个完全等同的sp3杂化轨道。然后,中心原子C以夹角均为109.5°的4个完全等同的sp3杂化轨道,分别与4个H原子的1s轨道重叠,形成4个sp3s型的σ键,故CH4分子的空间构型为正四面体。杂化轨道理论很好地解释了甲烷分子的正四面体结构。――――→――――→2.用杂化轨道理论解释BF3和BeCl2分子的形成及结构B原子的基态电子排布式为1s22s22p,在形成BF3分子的过程中,硼原子的一个2s电子激发到一个空的2p轨道中,1个2s轨道和2个2p轨道发生杂化,形成能量相同、成分相同的3个sp2杂化轨道。B原子的三个sp2杂化轨道间的夹角为120°,因此BF3具有平面三角形结构。――――→――――→Be原子的基态电子排布式是1s22s2,在形成BeCl2分子的过程中,Be的一个2s电子可以进入2p轨道,Be原子的1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道,Be原子的2个sp杂化轨道间的夹角为180°,因此BeCl2为直线形分子构型。――――→――――→3.用杂化轨道理论分析乙烯和乙炔分子的成键情况在乙烯分子中,C原子由1个s轨道和2个p轨道进行杂化,组成3个等同的sp2杂化轨道,sp2杂化轨道夹角成120°。乙烯中两个碳原子各用1个sp2轨道重叠形成1个C—Cσ键外,各又以2个sp2杂化轨道分别与2个氢原子的1s轨道重叠,形成4个σ键,这样形成的5个键在同一平面上,每个C原子还剩下1个py轨道,它们垂直于这5个σ键所在平面,互相平行电子的自旋方向相反,沿着x轴平行地侧面重叠,形成π键。在乙炔分子中碳原子由1个2s轨道和1个2p轨道进行杂化,组成2个sp杂化轨道。2个sp杂化轨道夹角为180°,在乙炔分子中,两个碳原子各以1个sp轨道互相重叠,形成1个C—Cσ键,每一个碳原子又各以1个sp轨道分别与1个氢原子形成σ键,此外每个碳原子还有2个互相垂直的未杂化的2p轨道,它们与另一个碳的2个2p轨道两两互相侧面重叠形成两个π键。4.杂化轨道的类型与分子空间构型的关系杂化类型spsp2sp3参与杂化的原子轨道及数目ns111np123杂化轨道数目234杂化轨道间的夹角180°120°109.5°杂化轨道示意图空间构型直线形平面三角形正四面体实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4议一议1.氨气分子中氮原子的原子轨道也是发生sp3杂化,为什么氨气空间构型与甲烷不同?答案NH3中N原子为sp3杂化,形成4个sp3杂化轨道,但NH3分子空间构型不是正四面体型,而是三角锥型,是因为氮原子形成NH3时有一对孤电子对。2.指出下列原子的杂化轨道类型、分子的结构式和空间构型。(1)CO2分子中的C采用________杂化,分子结构式为________,空间构型为__________。(2)CH2O中的C采用________,分子的结构式为__________,空间构型为__________。(3)CH4分子中的C采用________杂化,分子的结构式为________,空间构型为__________。(4)H2S分子中的S采用__________杂化,分子的结构式为____________,空间构型为__________。(5)BeH2分子的中Be采用________杂化,分子结构式为__________,空间构型为__________。(6)BBr3分子中的Be采用________杂化,分子的结构式为__________,空间构型为__________。(7)PH3分子中的P采用__________杂化,分子的结构式为__________,空间构型为________。答案(1)spO===C===O直线形(2)sp2平面三角形(3)sp3正四面体型(4)sp3V形(5)spH—Be—H直线形(6)sp2平面正三角形(7)sp3三角锥型二、价层电子对互斥模型1.价层电子对互斥模型的基本内容:分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,尽可能趋向彼此远离。(1)当中心原子的价电子全部参与成键时,为使价电子斥力最小,就要求尽...