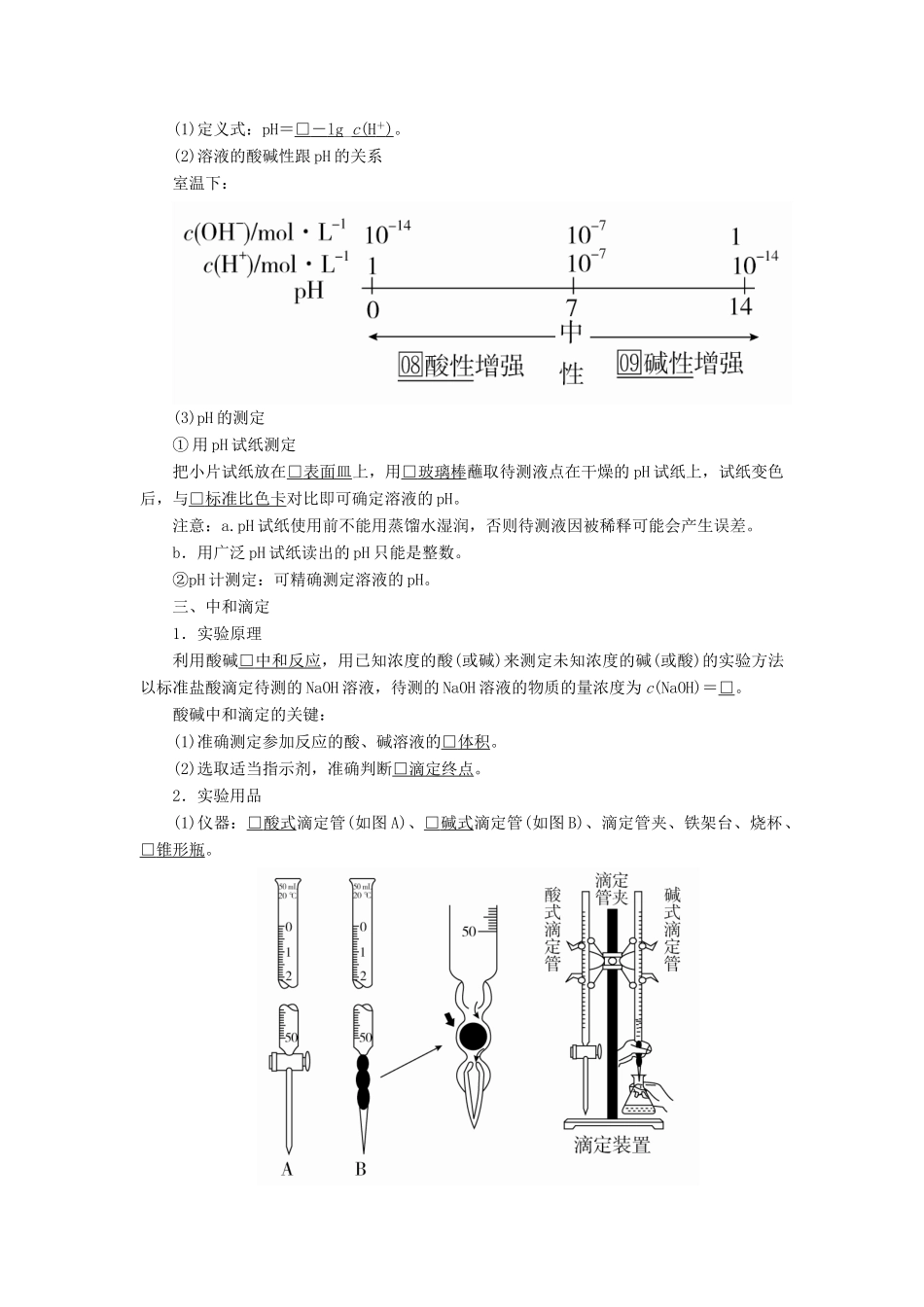
第25讲水的电离和溶液的pH一、水的电离1.电离方程式水是一种极弱的电解质,电离方程式为2H2O□H3O++OH-,简写为□H2OH++OH-。2.水的离子积常数Kw=c(H+)·c(OH-)。(1)室温下:Kw=□10-14_(mol·L-1)2。(2)影响因素:只与□温度有关,升高温度,Kw□增大。(3)适用范围:Kw不仅适用于纯水,也适用于稀的□电解质水溶液。(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw□不变。3.外界因素对水的电离平衡的影响结论:(1)加热,□促进水的电离,Kw□增大。(2)加入酸或碱,□抑制水的电离,Kw□不变。二、溶液的酸碱性1.溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。c(H+)>c(OH-),溶液呈□酸性,25℃时,pH□<7。c(H+)=c(OH-),溶液呈□中性,25℃时,pH□=7。c(H+)7。2.溶液的pH(1)定义式:pH=□-lg_c(H+)。(2)溶液的酸碱性跟pH的关系室温下:(3)pH的测定①用pH试纸测定把小片试纸放在□表面皿上,用□玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与□标准比色卡对比即可确定溶液的pH。注意:a.pH试纸使用前不能用蒸馏水湿润,否则待测液因被稀释可能会产生误差。b.用广泛pH试纸读出的pH只能是整数。②pH计测定:可精确测定溶液的pH。三、中和滴定1.实验原理利用酸碱□中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法以标准盐酸滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=□。酸碱中和滴定的关键:(1)准确测定参加反应的酸、碱溶液的□体积。(2)选取适当指示剂,准确判断□滴定终点。2.实验用品(1)仪器:□酸式滴定管(如图A)、□碱式滴定管(如图B)、滴定管夹、铁架台、烧杯、□锥形瓶。(2)试剂:标准液、待测液、指示剂、蒸馏水。(3)滴定管特征和使用要求①构造:“0”刻度线在上方,尖嘴部分无刻度。②精确度:读数可估计到□0.01mL。③洗涤:先用蒸馏水洗涤,再用□待装液润洗2~3次。④排气泡:酸、碱式滴定管中的液体在滴定前均要排出尖嘴中的气泡。⑤滴定管的选用酸性、氧化性的试剂用□酸式滴定管,因为酸性和氧化性物质易□腐蚀橡胶。碱性的试剂用□碱式滴定管,因为碱性物质易□腐蚀玻璃,致使□玻璃活塞无法打开。3.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定准备“八动词”(2)滴定过程“三动作”(3)终点判断“两数据”①最后一滴:滴入最后一滴,溶液颜色发生突变。②半分钟:颜色突变后,经振荡半分钟内不复原,视为滴定终点。(4)数据处理按上述操作重复2~3次,求出用去标准盐酸体积的□平均值,根据c(NaOH)=计算。4.常用酸碱指示剂及变色范围1.判断正误,正确的画“√”,错误的画“×”,并指明错因。(1)温度一定时,水的电离常数与水的离子积常数相等。(×)错因:Kw=K电离·c(H2O)。(2)进行中和滴定实验时,滴定管、锥形瓶均用待测液润洗。(×)错因:进行中和滴定实验时,锥形瓶不能用待测液洗,否则会使测得结果偏高。(3)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低。(×)错因:当待测液呈中性或酸性时,用湿润的pH试纸测的pH结果不会偏低。(4)用广范pH试纸测得某溶液的pH为3.4。(×)错因:广范pH试纸测得溶液的pH为整数值。(5)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性。(√)错因:__________________________________________________________(6)某溶液的c(H+)>10-7mol·L-1,则该溶液呈酸性。(×)错因:当温度大于25_℃时,纯水的c(H+)>10-7_mol·L-1,呈中性。(7)100℃的纯水中c(H+)=1×10-6mol·L-1,此时水呈酸性。(×)错因:纯水呈中性。2.教材改编题(据人教选修四P52T6)常温下pH为3的稀盐酸,其中由水电离出的c(H+)为()A.0.1mol/LB.0.3mol/LC.10-3mol/LD.10-11mol/L答案D3.教材改编题(据人教选修四P52T4)用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是()A.滴定前酸式滴定管需用标准盐酸润洗B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定C.往盛有20.00mLNaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定...