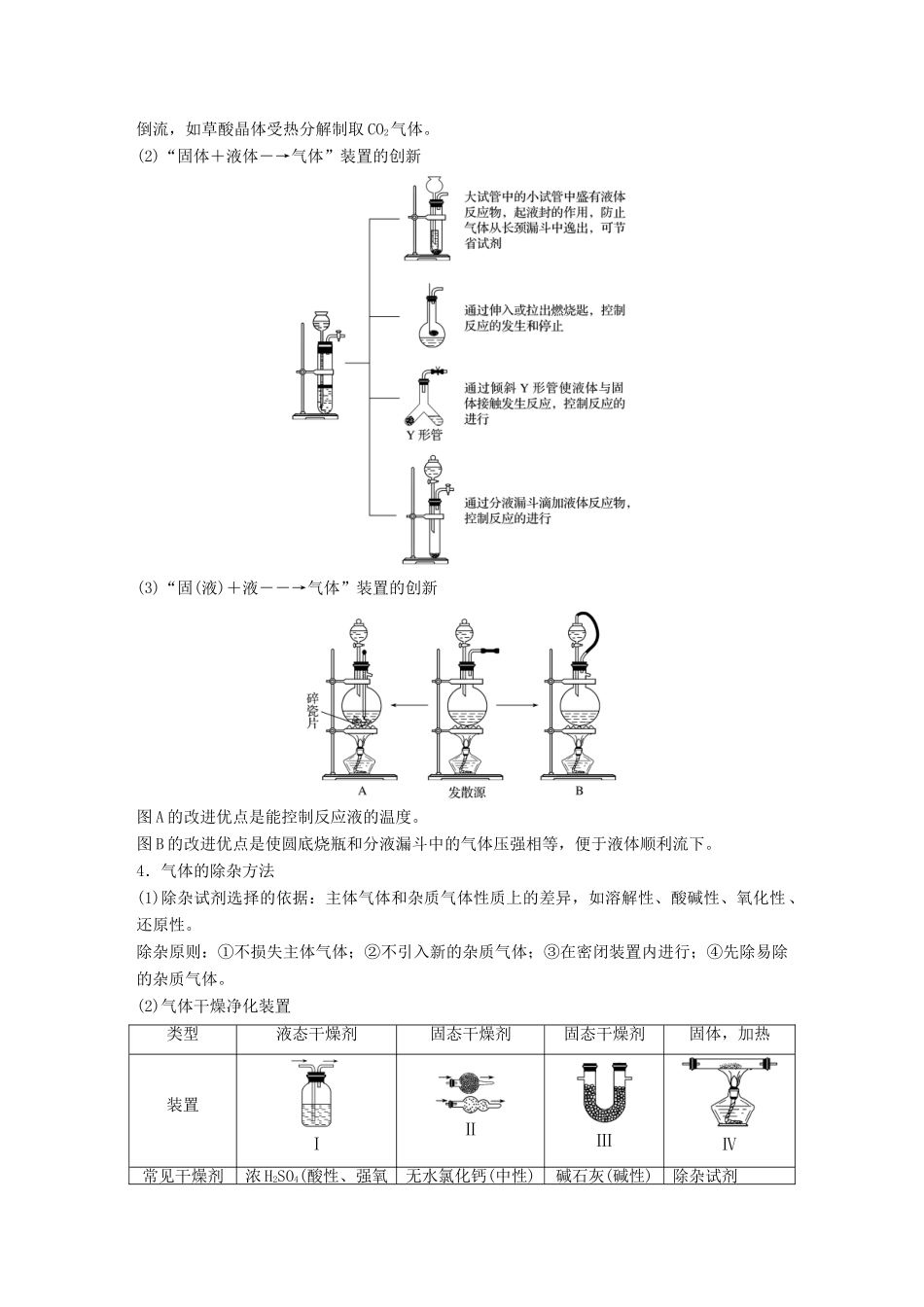
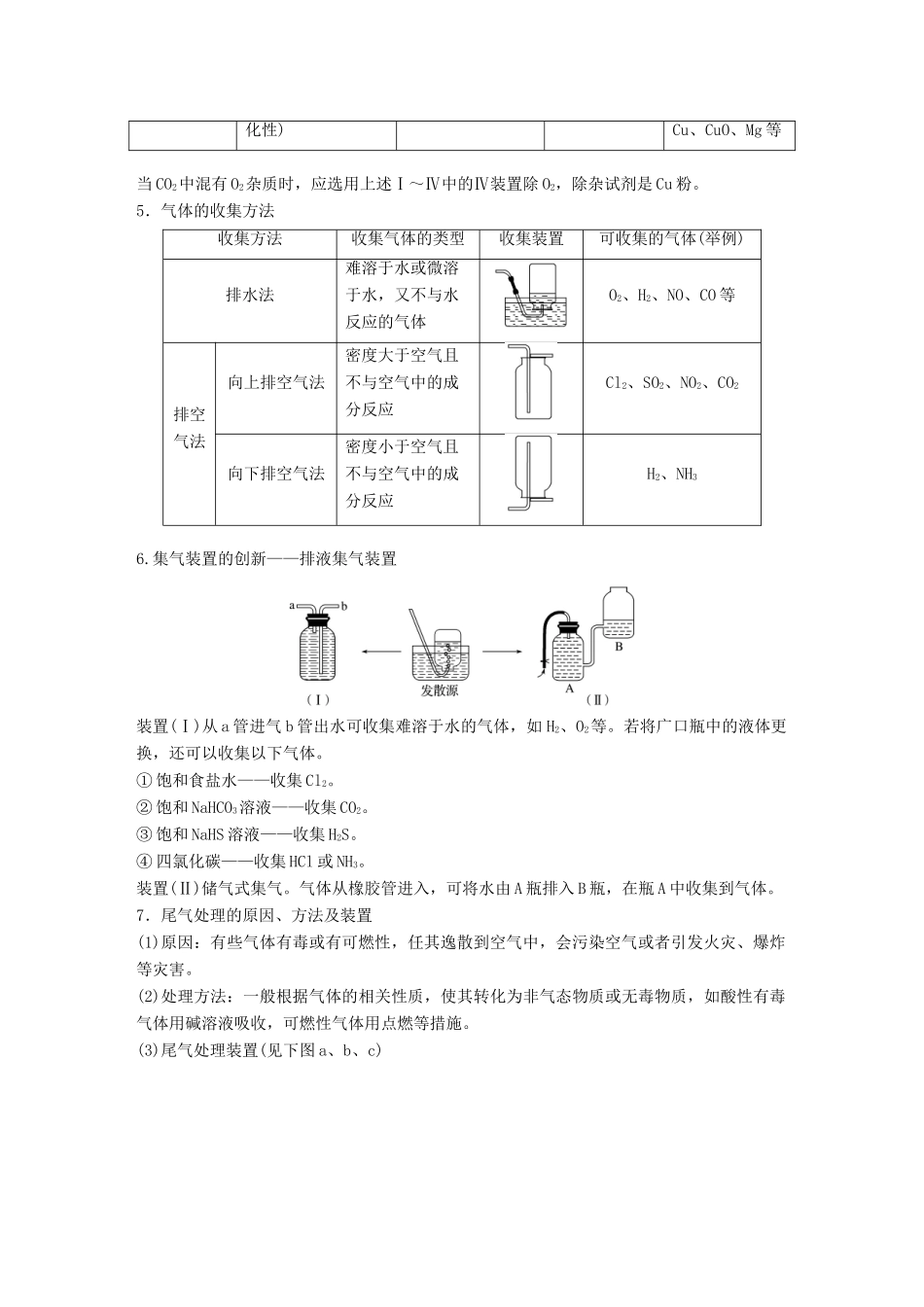
专题讲座二气体的实验室制备、净化和收集1.气体制备实验的基本思路2.重要气体的发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:(1)固体+固体――→气体发生装置:制备气体:O2、NH3、CH4等。(2)固体+液体或液体+液体――→气体发生装置:制备气体:Cl2、C2H4等。(3)固体+液体(不加热)―→气体发生装置:制备气体:选择合适的药品和装置能制取中学化学中常见的气体。3.气体制备装置的改进(1)改进的目的:用于加热易熔化的固体物质的分解,这样可有效地防止固体熔化时造成液体的倒流,如草酸晶体受热分解制取CO2气体。(2)“固体+液体―→气体”装置的创新(3)“固(液)+液――→气体”装置的创新图A的改进优点是能控制反应液的温度。图B的改进优点是使圆底烧瓶和分液漏斗中的气体压强相等,便于液体顺利流下。4.气体的除杂方法(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。(2)气体干燥净化装置类型液态干燥剂固态干燥剂固态干燥剂固体,加热装置ⅠⅡⅢⅣ常见干燥剂浓H2SO4(酸性、强氧无水氯化钙(中性)碱石灰(碱性)除杂试剂化性)Cu、CuO、Mg等当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。5.气体的收集方法收集方法收集气体的类型收集装置可收集的气体(举例)排水法难溶于水或微溶于水,又不与水反应的气体O2、H2、NO、CO等排空气法向上排空气法密度大于空气且不与空气中的成分反应Cl2、SO2、NO2、CO2向下排空气法密度小于空气且不与空气中的成分反应H2、NH36.集气装置的创新——排液集气装置装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。①饱和食盐水——收集Cl2。②饱和NaHCO3溶液——收集CO2。③饱和NaHS溶液——收集H2S。④四氯化碳——收集HCl或NH3。装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在瓶A中收集到气体。7.尾气处理的原因、方法及装置(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。(2)处理方法:一般根据气体的相关性质,使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。(3)尾气处理装置(见下图a、b、c)①实验室制取Cl2时,尾气的处理可采用b装置。②制取CO时,尾气处理可采用ac装置。③制取H2时,尾气处理可采用ac装置。题组一气体的制备与性质探究1.(2017·临沂市高三上学期期中考试)用下图所示装置进行实验,下列实验现象描述错误的是()实验试剂甲试剂乙试剂丙丙中的现象A稀盐酸CaCO3Na2SiO3溶液有白色沉淀生成B浓硫酸Na2SO3BaCl2溶液有白色沉淀生成C过氧化氢MnO2酸性KI淀粉溶液溶液变为蓝色D浓盐酸KMnO4Na2S溶液有淡黄色沉淀生成答案B解析A项,盐酸和碳酸钙反应生成CO2,CO2与硅酸钠溶液反应生成硅酸白色沉淀,正确;B项,浓硫酸与亚硫酸钠反应生成SO2,但SO2与氯化钡不反应,错误;C项,过氧化氢在二氧化锰的作用下分解生成氧气,氧气把碘化钾氧化为单质碘,碘遇淀粉显蓝色,正确;D项,浓盐酸与高锰酸钾混合生成氯气,氯气把硫化钠氧化为单质S,产生淡黄色沉淀,正确。2.(2018·曲阜市高三检测)用如图所示装置和相应试剂能达到实验目的的是()选项实验目的试剂a试剂b试剂c装置A验证非金属性:S>C>Si稀硫酸Na2CO3Na2SiO3溶液B制备纯净的氯气浓盐酸MnO2饱和食盐水C检验溶液X中含有CO盐酸溶液X澄清石灰水D除去Na2SO3中的氯水混合物NaOH溶液Na2SO4答案A解析A项,装置b中出现气体,说明硫酸的酸性强于碳酸,装置c中出现沉淀,说明碳酸的酸性强于硅酸,最高价氧化物对应水化物的酸性越强,非金属性越强,即S>C>Si,正确;B项,MnO2和浓盐酸反应,需要加热,此装置中没有加热装置,饱和食盐水除去氯气中的HCl,从装置c中出来的氯气中混有水蒸气,不是纯净的,错误;C项,装置b中加入盐酸,出现能使澄清石灰水变浑浊的气体,不能说明X中含有CO,可能含有HCO或SO或HSO,错误;D...