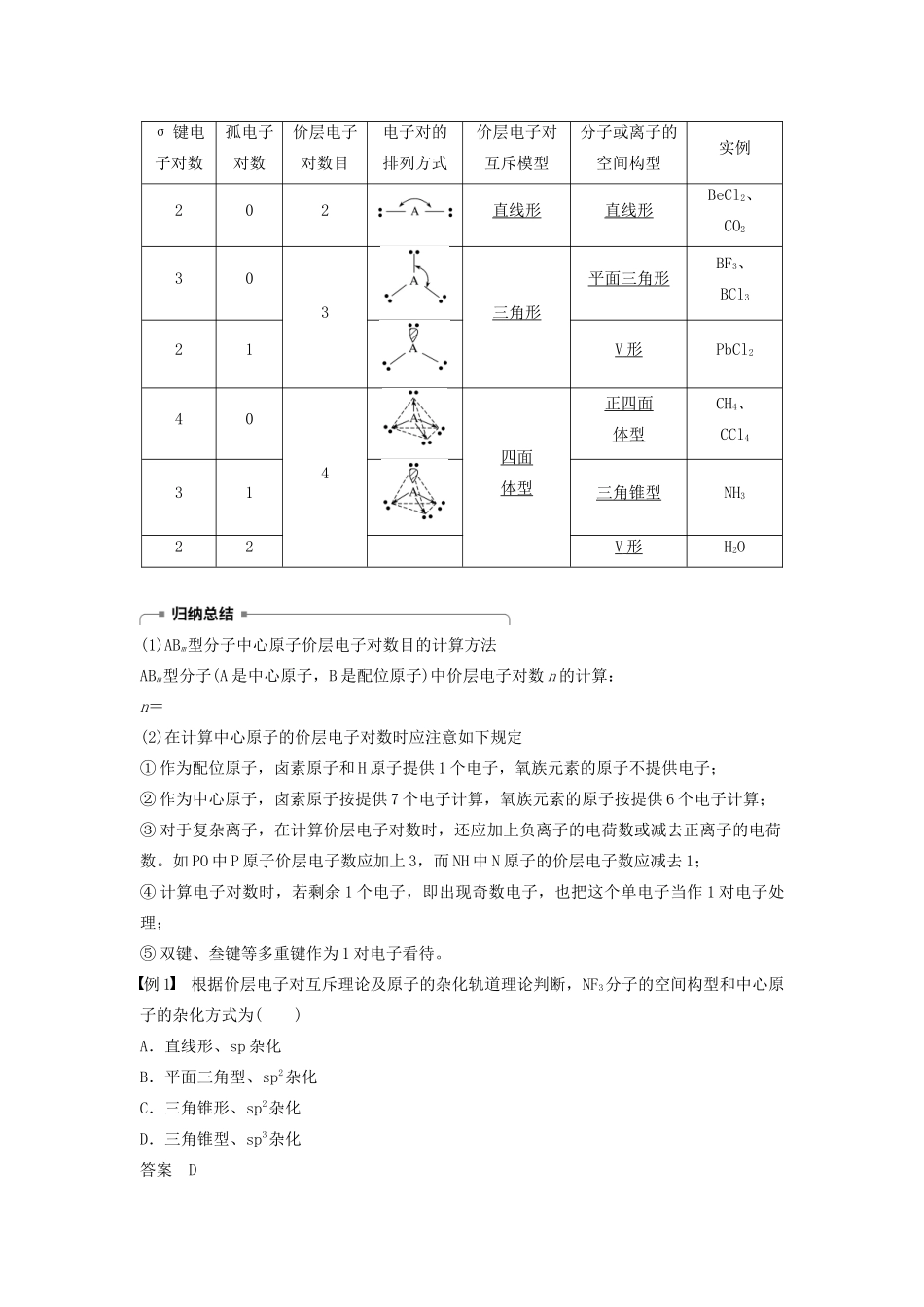
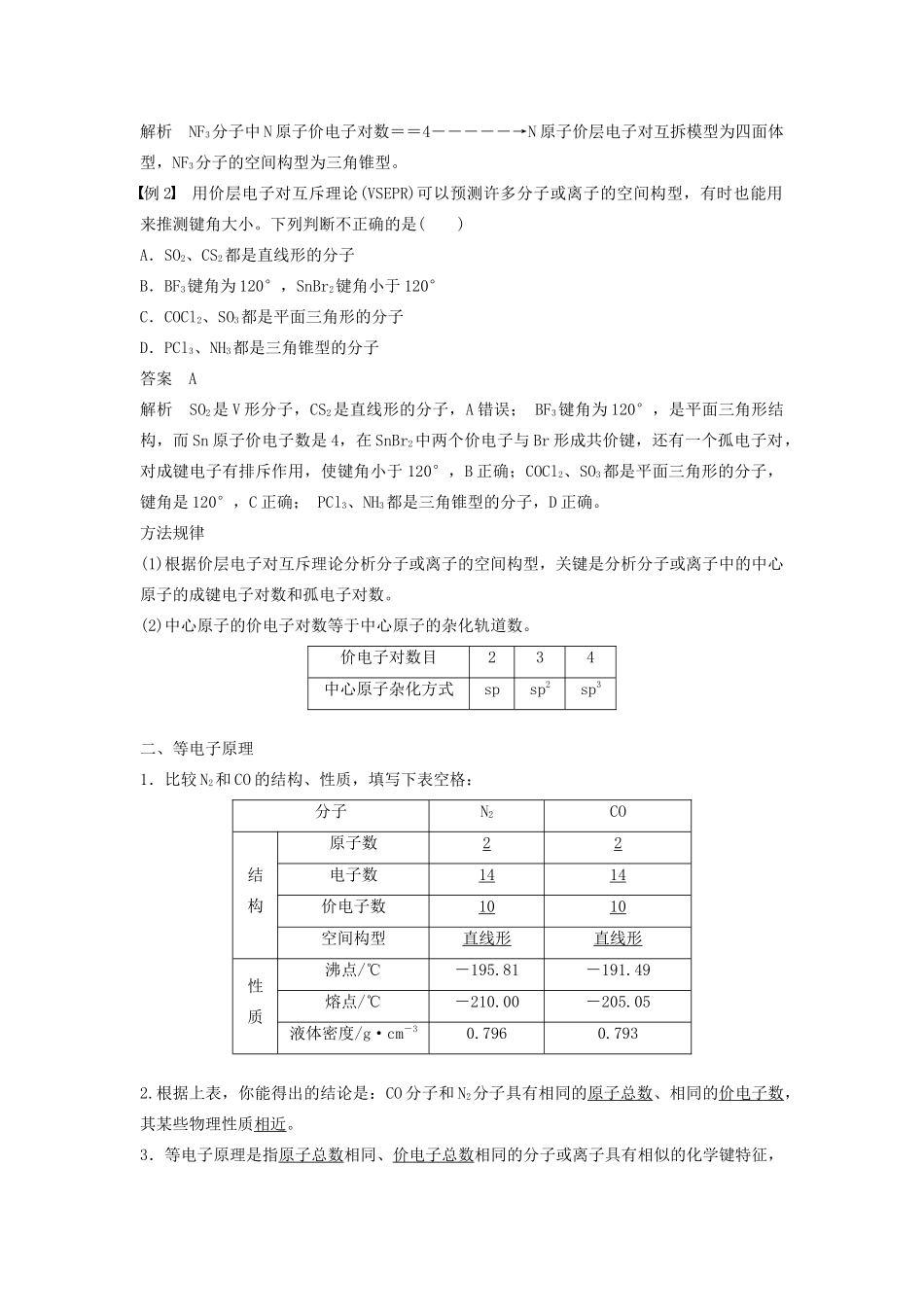
第一单元分子构型与物质的性质第2课时价层电子对互斥理论等电子原理[学习目标定位]理解价层电子对互斥理论和等电子原理,能根据有关理论、原理判断简单分子或离子的构型。一、价层电子对互斥理论1.价层电子对互斥理论的基本内容:分子中的价电子对——成键电子对和孤电子对由于相互排斥作用,而趋向于尽可能彼此远离。(1)当中心原子的价电子全部参与成键时,为使价电子斥力最小,就要求尽可能采取对称结构。(2)当中心原子的价电子部分参与成键时,未参与成键的孤电子对与成键电子对之间及孤电子对之间、成键电子对之间的斥力不同,从而影响分子构型。(3)电子对之间的夹角越大,相互之间的斥力越小。(4)含孤电子对的斥力由大到小顺序:孤电子对—孤电子对>孤电子对—单键>单键—单键。2.价层电子对互斥理论与分子的空间构型(1)分析中心原子中的价电子全部参与形成共价键的分子的空间构型并完成下表(由中心原子周围的原子数n来预测):ABn空间构型范例n=2直线形CO2、BeCl2n=3平面三角形CH2O、BF3n=4正四面体型CH4、CCl4(2)中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分子的空间构型:中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的空间构型发生变化,如:①H2O为AB2型分子,氧原子上有两对孤电子对参与互相排斥,所以H2O分子的空间构型为V形而不是直线形。②NH3分子中氮原子上有一对孤电子对参与互相排斥,故NH3的空间构型不能为平面三角形。③常见分子的价层电子对互斥模型和空间构型σ键电子对数孤电子对数价层电子对数目电子对的排列方式价层电子对互斥模型分子或离子的空间构型实例202直线形直线形BeCl2、CO2303三角形平面三角形BF3、BCl321V形PbCl2404四面体型正四面体型CH4、CCl431三角锥型NH322V形H2O(1)ABm型分子中心原子价层电子对数目的计算方法ABm型分子(A是中心原子,B是配位原子)中价层电子对数n的计算:n=(2)在计算中心原子的价层电子对数时应注意如下规定①作为配位原子,卤素原子和H原子提供1个电子,氧族元素的原子不提供电子;②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;③对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数。如PO中P原子价层电子数应加上3,而NH中N原子的价层电子数应减去1;④计算电子对数时,若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理;⑤双键、叁键等多重键作为1对电子看待。例1根据价层电子对互斥理论及原子的杂化轨道理论判断,NF3分子的空间构型和中心原子的杂化方式为()A.直线形、sp杂化B.平面三角型、sp2杂化C.三角锥形、sp2杂化D.三角锥型、sp3杂化答案D解析NF3分子中N原子价电子对数==4―――――→N原子价层电子对互拆模型为四面体型,NF3分子的空间构型为三角锥型。例2用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小。下列判断不正确的是()A.SO2、CS2都是直线形的分子B.BF3键角为120°,SnBr2键角小于120°C.COCl2、SO3都是平面三角形的分子D.PCl3、NH3都是三角锥型的分子答案A解析SO2是V形分子,CS2是直线形的分子,A错误;BF3键角为120°,是平面三角形结构,而Sn原子价电子数是4,在SnBr2中两个价电子与Br形成共价键,还有一个孤电子对,对成键电子有排斥作用,使键角小于120°,B正确;COCl2、SO3都是平面三角形的分子,键角是120°,C正确;PCl3、NH3都是三角锥型的分子,D正确。方法规律(1)根据价层电子对互斥理论分析分子或离子的空间构型,关键是分析分子或离子中的中心原子的成键电子对数和孤电子对数。(2)中心原子的价电子对数等于中心原子的杂化轨道数。价电子对数目234中心原子杂化方式spsp2sp3二、等电子原理1.比较N2和CO的结构、性质,填写下表空格:分子N2CO结构原子数22电子数1414价电子数1010空间构型直线形直线形性质沸点/℃-195.81-191.49熔点/℃-210.00-205.05液体密度/g·cm-30.7960.7932.根据上表,你能得出的结论是:CO分子和N2分子具有相同的原子总数、相同的价电子数,其某些物理性质相近。3.等...