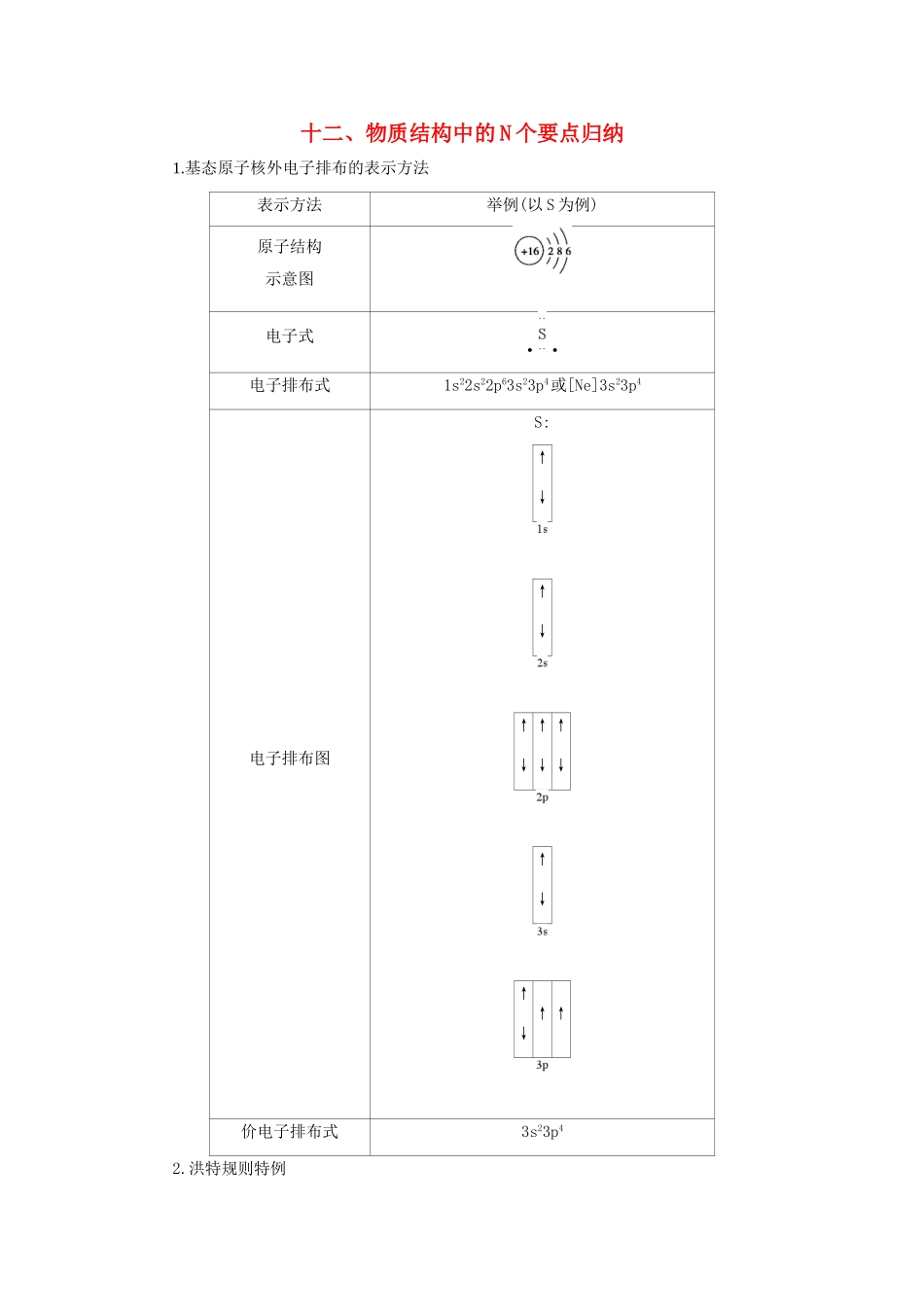
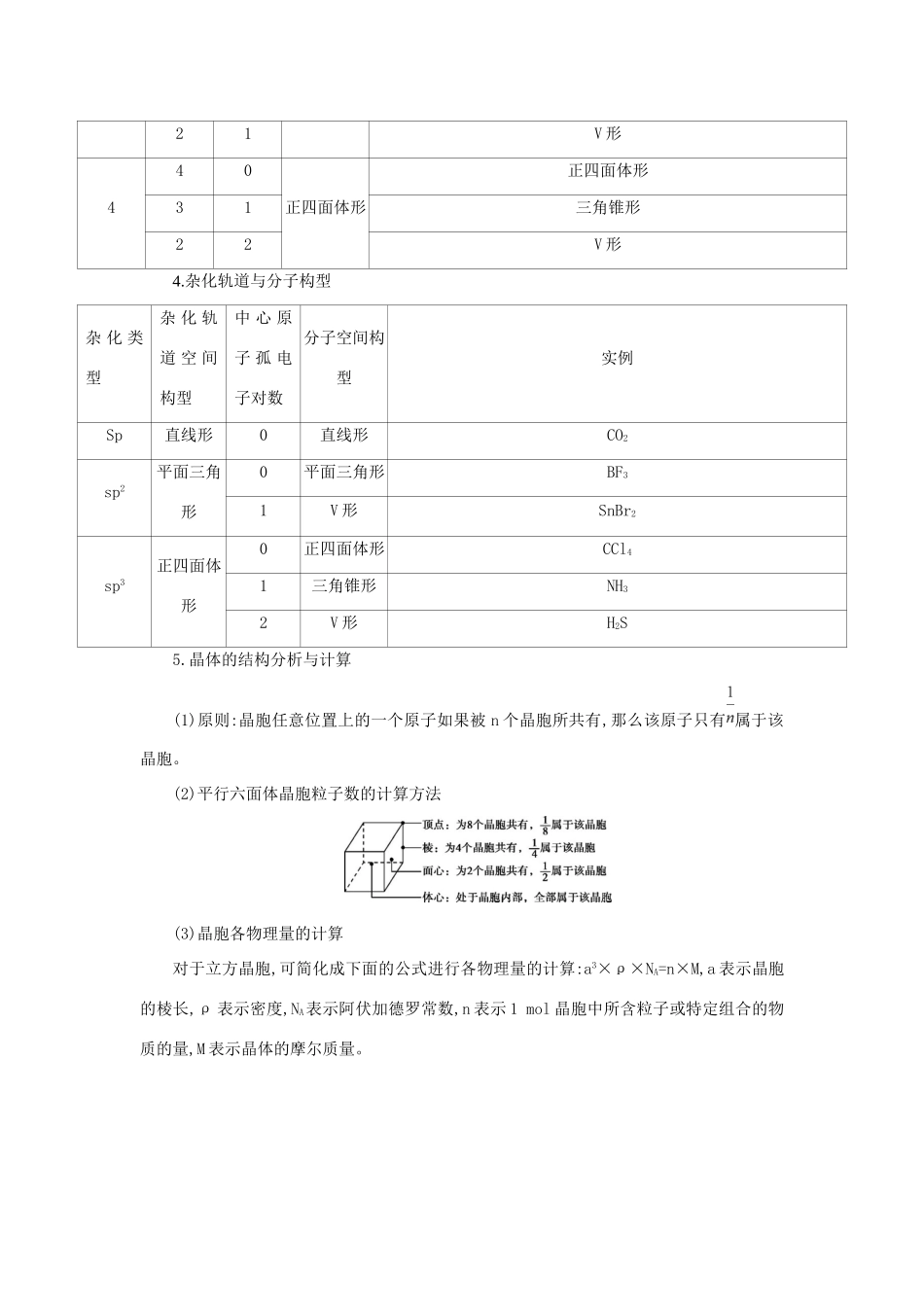
十二、物质结构中的N个要点归纳1.基态原子核外电子排布的表示方法表示方法举例(以S为例)原子结构示意图电子式··电子排布式1s22s22p63s23p4或[Ne]3s23p4电子排布图S:↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑价电子排布式3s23p42.洪特规则特例当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量较低,较稳定。如基态24Cr的核外电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。▶特别提示电子的填充顺序与排布式的书写顺序不完全一致,如20号以后的元素虽然电子先排在能量较低的4s轨道,后填入3d轨道,但书写电子排布式时仍把3d写在前面。3.价层电子对互斥理论与分子构型(1)价层电子对互斥理论认为,分子的立体结构是“价层电子对”相互排斥的结果,可用来预测分子的空间构型。(2)用价层电子对互斥理论推测分子的空间构型的关键是判断分子中的中心原子上的价层电子对数,对于ABm型分子(或离子),价层电子对数=中心原子形成的σ键电子对数+中心原子上的孤电子对数。①σ键电子对数=与中心原子结合的原子数。②孤电子对数=(a-mb)。a:中心原子价电子数m:与中心原子结合的原子数b:与中心原子结合的原子最多能接受的电子数(H为1,其他的为8减去该原子的价电子数)(3)价层电子对与分子的立体构型的关系价层电子对立体构型分子的立体构型①中心原子无孤电子对时,两者的立体构型一致。②当中心原子上有孤电子对时,两者的立体构型不一致。如:价层电子对数σ键电子对数孤电子对数价层电子对空间构型分子空间构型220直线形直线形330平面三角形平面三角形21V形440正四面体形正四面体形31三角锥形22V形4.杂化轨道与分子构型杂化类型杂化轨道空间构型中心原子孤电子对数分子空间构型实例Sp直线形0直线形CO2sp2平面三角形0平面三角形BF31V形SnBr2sp3正四面体形0正四面体形CCl41三角锥形NH32V形H2S5.晶体的结构分析与计算(1)原则:晶胞任意位置上的一个原子如果被n个晶胞所共有,那么该原子只有属于该晶胞。(2)平行六面体晶胞粒子数的计算方法(3)晶胞各物理量的计算对于立方晶胞,可简化成下面的公式进行各物理量的计算:a3×ρ×NA=n×M,a表示晶胞的棱长,ρ表示密度,NA表示阿伏加德罗常数,n表示1mol晶胞中所含粒子或特定组合的物质的量,M表示晶体的摩尔质量。