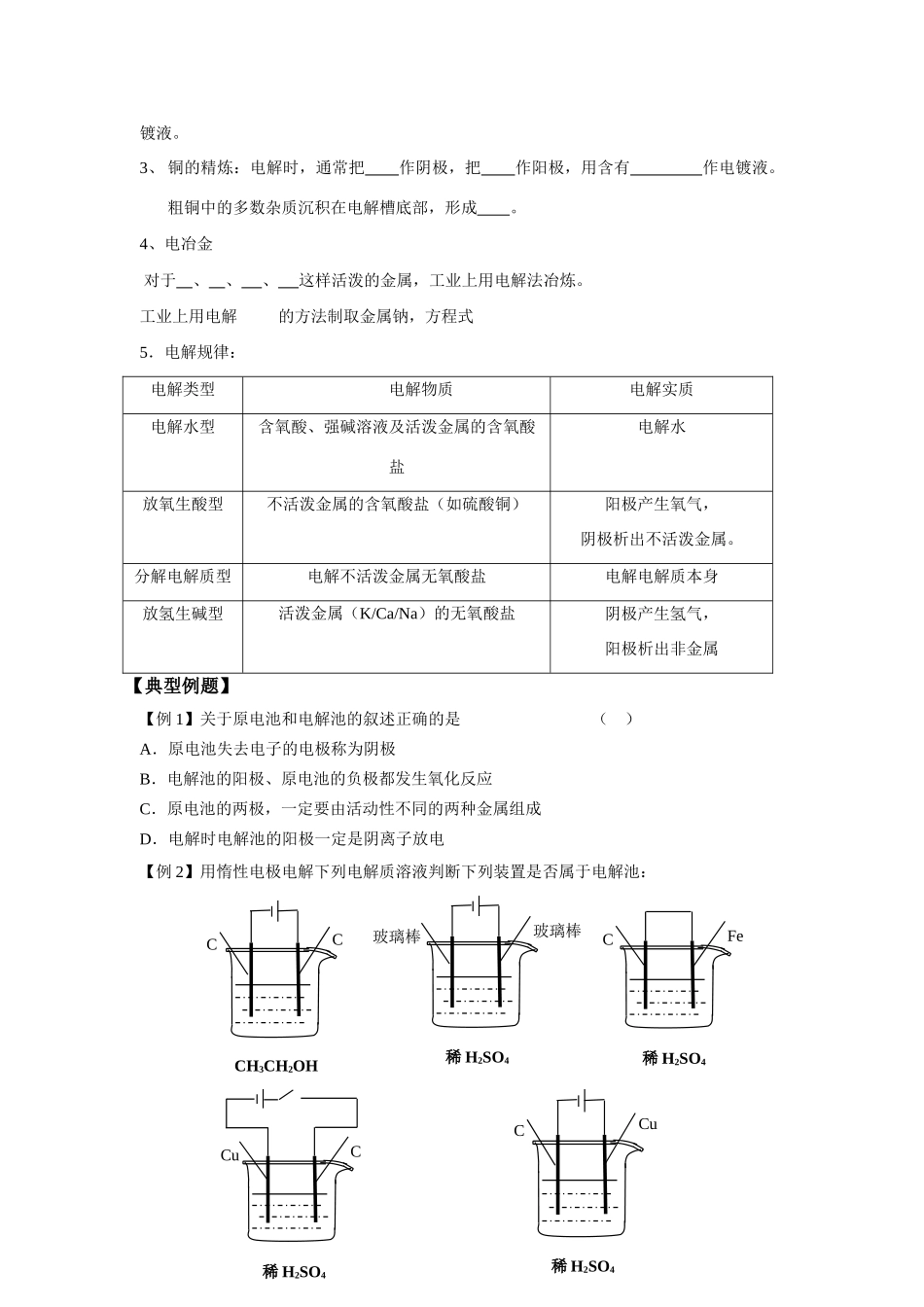
第三节电解池内容解读1.理解电解原理,会判断电解池、电极产物、电极周围溶液pH值及整个溶液pH值变化;2.掌握电解电极方程式的书写;3.通过电解知识的学习,了解氯碱工业,电镀,冶金的原理,发现电解知识在日常生活和工农业生产中的广泛应用,激发学生勇于创新、积极实践的科学态度。【预习提纲】一、电解池1、实验探究如图所示:与电源正极相连的电极叫极,发生反应;与电源负极相连的电极叫极,发生反应。实验原理:CuCl2溶液能导电是因为存在,通电后这些自由移动的离子在电场作用下作移动,带负电的氯离子向极移动,带正电的铜离子向极移动,发生氧化还原反应。两支电极上发生的反应为:阳极:。阴极:。总反应式:。2、电解:使电流通过溶液而在阴、阳两极引起的过程。该过程中能转化为能。3、电解池:将能转化为能的装置。4、构成电解池的条件:①②③5、闭合回路的形成:通电时电子从电源的极沿着导线到达极,经过形成内电路,从极沿着导线回到电源的极。6、放电顺序阴极上:阴极产物与电极材料无关,电极本身不参与反应,参与反应的是溶液中的。金属越不活泼,对应阳离子氧化性越,越得电子。由此根据金属活动顺序表,分析下列离子得电子能力的强弱:CuCl2溶液CC×Ag+Cu2+H+(酸)Pb2+Fe2+Zn2+H+(水)Al3+…小结:质量增加,或有氢气产生的电极一定是极。阳极上:(1)用一般的金属材料做阳极,电解时阳极上是失去电子。(2)阳极如果用石墨或金属铂(Pt)等难失电子的物质做惰性电极时,则是溶液中失去电子。阴离子还原性越强就越失去电子。根据非金属性的强弱,分析下列离子失电子能力的强弱:S2-I-Br-Cl-OH-最高价含氧酸根(如SO42-)F-。注意:放电顺序这个考点不难,但要细心,否则极易出错。要能根据放电顺序判断阴、阳极产物,如果是惰性电极则直接考虑溶液中离子的放电顺序。二、原电池与电解池的比较装置类别原电池电解池举例(图)电极名称反应类型溶液中离子移动方向能量转变反应是否自发进行三、电解原理的应用:1、氯碱工业:电解制、和。电极反应方程式:阳极:阴极:总方程式该电解池中阳极用电极(金属、惰性)2、电镀:电镀时,通常把作阴极,把作阳极,用含有作电稀H2SO4CuC稀H2SO4CCuCCCH3CH2OH稀H2SO4FeC稀H2SO4玻璃棒玻璃棒镀液。3、铜的精炼:电解时,通常把作阴极,把作阳极,用含有作电镀液。粗铜中的多数杂质沉积在电解槽底部,形成。4、电冶金对于、、、这样活泼的金属,工业上用电解法冶炼。工业上用电解的方法制取金属钠,方程式5.电解规律:电解类型电解物质电解实质电解水型含氧酸、强碱溶液及活泼金属的含氧酸盐电解水放氧生酸型不活泼金属的含氧酸盐(如硫酸铜)阳极产生氧气,阴极析出不活泼金属。分解电解质型电解不活泼金属无氧酸盐电解电解质本身放氢生碱型活泼金属(K/Ca/Na)的无氧酸盐阴极产生氢气,阳极析出非金属【典型例题】【例1】关于原电池和电解池的叙述正确的是()A.原电池失去电子的电极称为阴极B.电解池的阳极、原电池的负极都发生氧化反应C.原电池的两极,一定要由活动性不同的两种金属组成D.电解时电解池的阳极一定是阴离子放电【例2】用惰性电极电解下列电解质溶液判断下列装置是否属于电解池:【例3】用惰性电极电解下列电解质溶液,请你分析下列问题(注意得失电子的顺序)1、CuCl2阴极:阳极总方程式:电解质浓度,pH电解对象:,要把电解质溶液复原,加。2、NaCl阴极:阳极总方程式:电解质浓度,pH电解对象:,要把电解质溶液复原,加。3、CuSO4阴极:阳极总方程式:电解质浓度,pH电解对象:,要把电解质溶液复原,加。4、NaOH:阴极:阳极总方程式:电解质浓度,pH5、H2SO4:阴极:阳极总方程式:电解质浓度,pH【例4】用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况),从而可知M的相对原子质量是()A.B.C.D.【同步训练】1.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是()A.原电池正极和电解池阳极所发生的反应B.原电池正极和电解池阴极所发生的C.原电池负极和电解池阳极所发生的反应D.原电池负极和电解池阴极所发生的反应2.关...