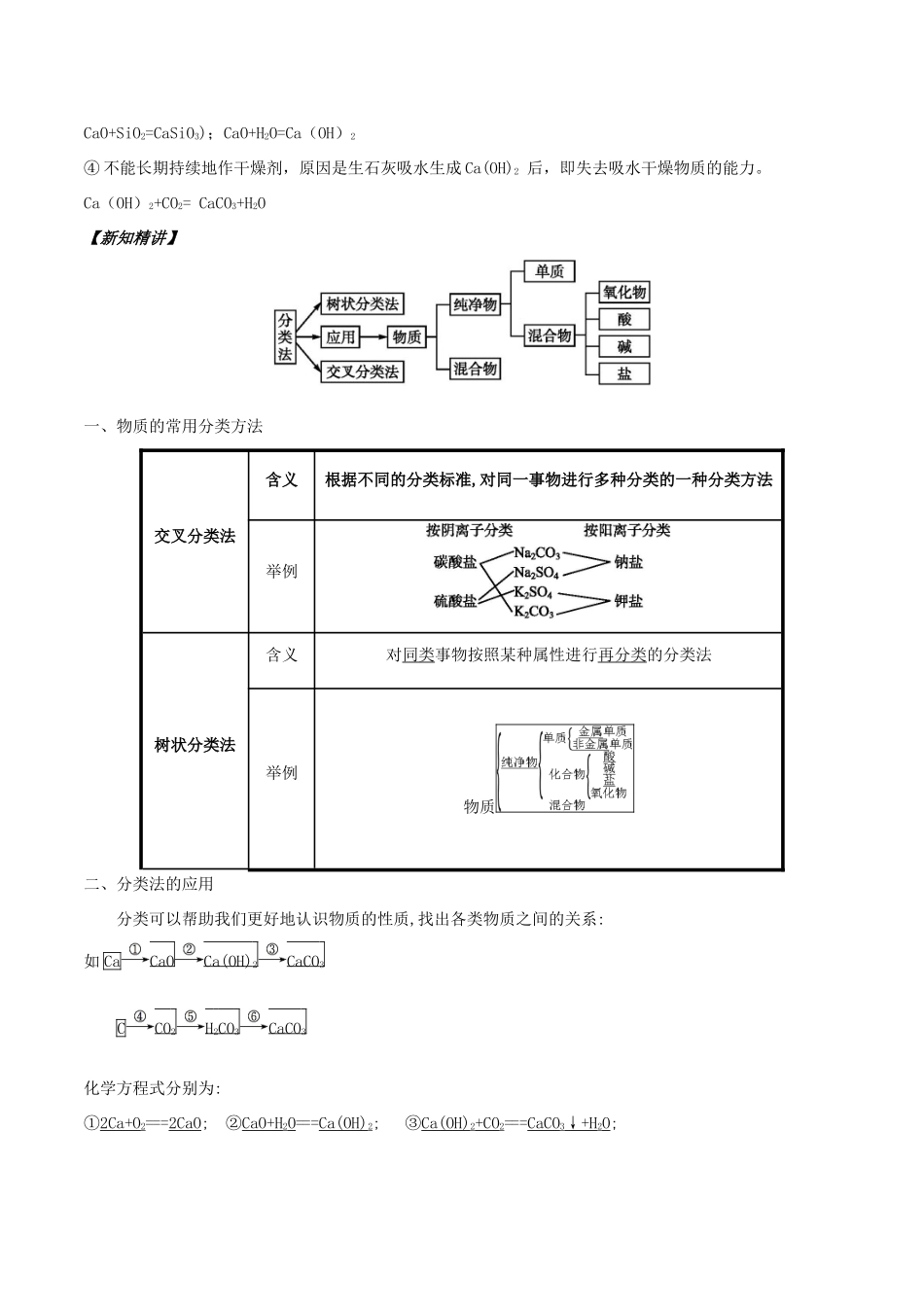
专题06简单分类法及其应用【知识回放】(1)我们曾经将元素分为金属元素和元素,如(写出4种即可)是金属元素,S、P、Cl是元素。(2)化学反应分为四种基本反应类型,即、、、。(3)物质分为和纯净物;纯净物又可以分为单质和;单质可分为金属单质和单质;化合物可分为氧化物、、、。(4)混合物:由种或种以上的物质组成,例如:空气。纯净物:只由种物质组成,例如:水、水银、蓝矾(CuSO4•5H2O)都是纯净物,冰与水混合是纯净物。(5)单质:由同种(或一种)元素组成的,例如:氧气(液氧)、水银、液氯。(6)化合物:由种或种以上的元素组成的纯净物,例如:氯化氢、氨气。(7)氧化物:由种元素组成且其中一种是元素的化合物,例如:水、一氧化碳、二氧化碳。(8)有些食品的包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。①生石灰属于哪种类别的物质?。②生石灰可作干燥剂的理由是(用化学方程式表示)。③生石灰还可以与哪些类别的物质发生化学反应?列举三例,并写出化学方程式。④小纸袋中的物质能否长期持续地作干燥剂?为什么?【答案】(1)非金属元素Na、Mg、Al、Fe非金属元素(2)化合反应、分解反应、置换反应、复分解反应(3)混合物化合物非金属单质酸、碱、盐(4)两两一(5)纯净物(6)两两(7)两氧(8)①生石灰属于碱性氧化物(或金属氧化物)②CaO+H2O=Ca(OH)2③生石灰还可与酸、酸性氧化物、水等物质反应。如:CaO+2HCl=CaCl2+H2O;CaO+CO2=CaCO3(或CaO+SiO2=CaSiO3);CaO+H2O=Ca(OH)2④不能长期持续地作干燥剂,原因是生石灰吸水生成Ca(OH)2后,即失去吸水干燥物质的能力。Ca(OH)2+CO2=CaCO3+H2O【新知精讲】一、物质的常用分类方法交叉分类法含义根据不同的分类标准,对同一事物进行多种分类的一种分类方法举例树状分类法含义对同类事物按照某种属性进行再分类的分类法举例物质二、分类法的应用分类可以帮助我们更好地认识物质的性质,找出各类物质之间的关系:如CaCaOCa(OH)2CaCO3CCO2H2CO3CaCO3化学方程式分别为:①2Ca+O2===2CaO;②CaO+H2O===Ca(OH)2;③Ca(OH)2+CO2===CaCO3↓+H2O;④C+O2CO2;⑤CO2+H2O===H2CO3;⑥Ca(OH)2+H2CO3===CaCO3↓+2H2O。【科学探究】探究一常用的分类方法问题导引1.请用树状分类法对初中所学过的四种基本化学反应类型进行分类。提示化学反应2.用交叉分类法对碱进行分类。(请连线)按溶解性分提示探究二常见分类法的应用问题导引1.已知:Fe+H2SO4===FeSO4+H2↑,那么所有金属都能与酸反应生成盐和氢气吗?提示只有金属活动性顺序中排在氢前面的金属才能与酸反应生成H2。2.盐与盐之间能发生复分解反应,那么发生反应的条件是什么?提示盐与盐之间发生复分解反应的条件是生成难溶的盐。【重点突破】1.根据物质的组成与性质对物质进行分类2.纯净物和混合物的两个认识误区(1)误认为由不同状态的同种物质组成的混合体系是混合物。冰和水的状态不同,但它们的成分都是水,所以冰水“混合物”其实是纯净物。(2)误认为由同种元素组成的物质是纯净物,金刚石和石墨都是由碳元素组成的单质,但是二者混合后属于混合物。3.单质、氧化物、酸、碱、盐的转化关系(1)转化关系图(2).转化关系图的内涵A、表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐。B、表示基本反应规律(图中所示箭头)。C、表示物质的性质。D、表示物质(特别是盐)的制法。(3).上述转化关系图使用时的注意事项A、各类物质的相互转化关系图并非无所不含,有以下一些规律未能体现:H2、C、CO还原CuO或Fe2O3;CuSO4转化成胆矾晶体。B、复分解反应发生的条件:能生成沉淀、气体或水。C、金属间发生置换反应规律的条件:“金属活动性强换弱”。①判断金属与酸反应时:金属必须排在H前面;酸不可用硝酸、浓硫酸。②判断金属与盐反应时:必须同时满足“排在前面的金属;可溶性盐”。【典题探究】典例1无机化合物可根据其组成和性质进行分类(1)上图所示的物质分类方法名称是。(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。物质类别酸碱盐氧化物氢化物化学式①HCl②③④Ba(OH)2⑤Na2CO3⑥⑦CO2⑧Na2O⑨NH3⑩H2O...