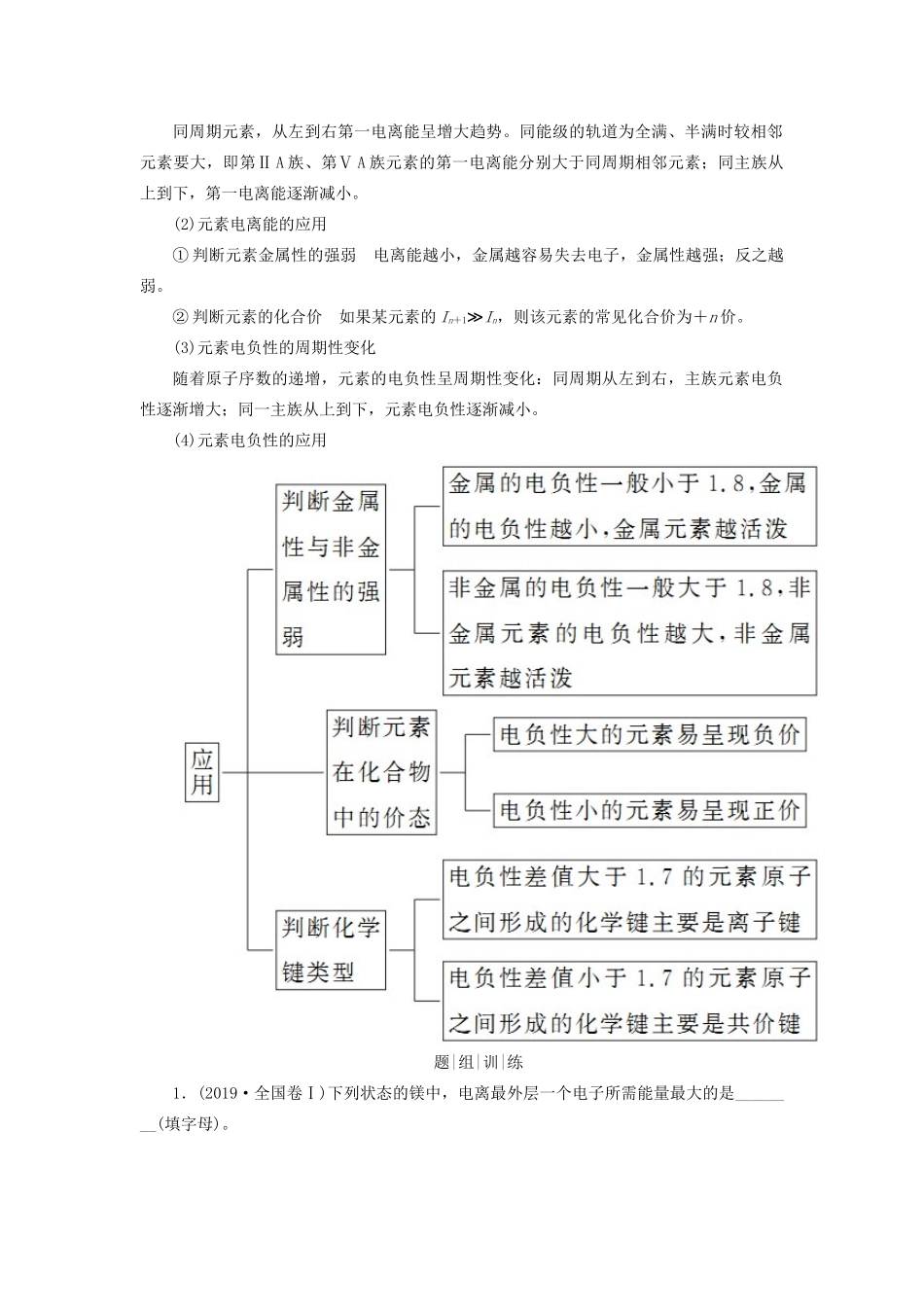
专题15物质结构与性质(选考)考|情|分|析考点1原子结构与性质核|心|回|顾1.排布规律(1)能量最低原理:基态原子核外电子优先占据能量最低的原子轨道。(2)泡利原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子。(3)洪特规则:原子核外电子在能量相同的各轨道上排布时,电子总是优先单独占据一个轨道,且自旋状态相同。2.核外电子排布的表示方法(1)电子排布式按电子排入各电子层中各能级的先后顺序,用能级符号依次写出各能级中的电子数,同时注意特例。如Cr:1s22s22p63s23p63d54s1(2)简化电子排布式“[稀有气体]+价层电子”的形式表示。如Cr:[Ar]3d54s1(3)电子排布图用方框表示原子轨道,用“↑”或“↓”表示自旋方向不同的电子,按排入各电子层中各能级的先后顺序和在轨道中的排布情况书写。如S:3.电离能和电负性(1)元素第一电离能的周期性变化同周期元素,从左到右第一电离能呈增大趋势。同能级的轨道为全满、半满时较相邻元素要大,即第ⅡA族、第ⅤA族元素的第一电离能分别大于同周期相邻元素;同主族从上到下,第一电离能逐渐减小。(2)元素电离能的应用①判断元素金属性的强弱电离能越小,金属越容易失去电子,金属性越强;反之越弱。②判断元素的化合价如果某元素的In+1≫In,则该元素的常见化合价为+n价。(3)元素电负性的周期性变化随着原子序数的递增,元素的电负性呈周期性变化:同周期从左到右,主族元素电负性逐渐增大;同一主族从上到下,元素电负性逐渐减小。(4)元素电负性的应用题|组|训|练1.(2019·全国卷Ⅰ)下列状态的镁中,电离最外层一个电子所需能量最大的是________(填字母)。解析由题给信息知,A项和D项代表Mg+,B项和C项代表Mg。A项,Mg+再失去一个电子较难,即第二电离能大于第一电离能,所以电离最外层一个电子所需能量A大于B;3p能级的能量高于3s,3p能级上电子较3s上易失去,故电离最外层一个电子所需能量A>C、A>D,故选A。答案A2.(2019·全国卷Ⅱ)(1)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为________。(2)比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。解析(1)Fe的价层电子排布式为3d64s2,其阳离子Fe2+、Fe3+的价层电子排布式分别是3d6、3d5,二者均首先失去4s轨道上的电子;Sm失去3个电子成为Sm3+时首先失去6s轨道上的电子,然后失去1个4f轨道上的电子,故Sm3+的价层电子排布式为4f5。与O2-电子层结构相同,核电荷数越大,原子核对核外电子的吸引力越大,离子半径越小,故离子半径F-