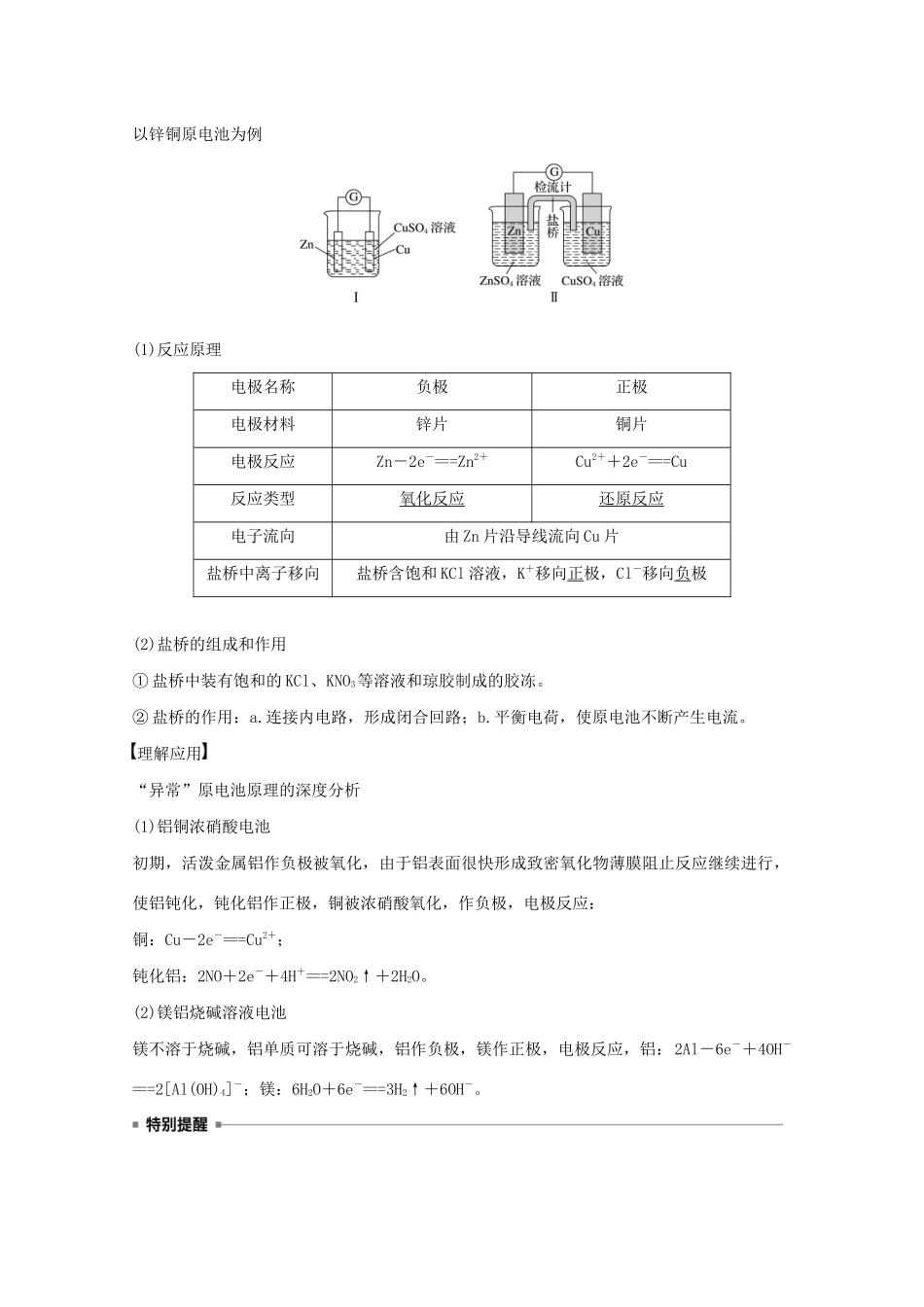
第21讲化学能转化为电能——电池目标要求1.以原电池为例认识化学能可以转化为电能,从氧化还原反应的角度认识原电池的工作原理,能设计简单的原电池。2.体会提高燃料的燃烧效率、开发高纯清洁燃料和研制新型电池的重要性。3.认识化学能与电能相互转化的实际意义及其重要应用,了解原电池及其常见化学电源的工作原理;能利用相关信息分析化学电源的工作原理,开发新型电池。4.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,能利用电化学原理解释金属腐蚀现象,选择设计防腐措施。1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。2.构成条件(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。(2)二看两电极:一般是活泼性不同的两电极。(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。理解应用在如图所示的4个装置中,不能形成原电池的是______(填序号),并指出原因______________________________________________________________________________________。答案①④①中酒精是非电解质;④中未形成闭合回路3.工作原理以锌铜原电池为例(1)反应原理电极名称负极正极电极材料锌片铜片电极反应Zn-2e-===Zn2+Cu2++2e-===Cu反应类型氧化反应还原反应电子流向由Zn片沿导线流向Cu片盐桥中离子移向盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极(2)盐桥的组成和作用①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。②盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。理解应用“异常”原电池原理的深度分析(1)铝铜浓硝酸电池初期,活泼金属铝作负极被氧化,由于铝表面很快形成致密氧化物薄膜阻止反应继续进行,使铝钝化,钝化铝作正极,铜被浓硝酸氧化,作负极,电极反应:铜:Cu-2e-===Cu2+;钝化铝:2NO+2e-+4H+===2NO2↑+2H2O。(2)镁铝烧碱溶液电池镁不溶于烧碱,铝单质可溶于烧碱,铝作负极,镁作正极,电极反应,铝:2Al-6e-+4OH-===2[Al(OH)4]-;镁:6H2O+6e-===3H2↑+6OH-。原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定势。(1)原电池工作时,正极表面一定有气泡产生(×)(2)Mg—Al形成的原电池,Mg一定作负极(×)(3)在原电池中,正极材料本身一定不参与电极反应,负极材料本身一定要发生氧化反应(×)(4)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳(√)(5)铁铜原电池中,负极反应式为Fe—3e-===Fe3+(×)(6)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动(×)(7)锌铜原电池中,因为有电子通过电解质溶液,形成闭合回路,所以有电流产生(×)判断原电池正、负极的5种方法题组一原电池工作原理(不定项选择题)1.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是()A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡答案C解析A项,由锌的活泼性大于铜,可知铜电极为正极,在正极上Cu2+得电子发生还原反应生成Cu,错误;B项,由于阳离子交换膜只允许阳离子和水分子通过,故甲池的c(SO)不变,错误;C项,在乙池中Cu2++2e-===Cu,同时甲池中的Zn2+通过阳离子交换膜进入乙池中,由于M(Zn2+)>M(Cu2+),故乙池溶液的总质量增加,正确;D项,阳离子交换膜只允许阳离子和水分子通过,电解过程中Zn2+通过阳离子交换膜移向正极保持溶液中电荷平衡,阴离子是不能通过交换膜的,错误。2.分析下图所示的四个原电池装置,其中结论正确的是()A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为O2+2H2O+4e-===4OH-答案BD解析②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,...