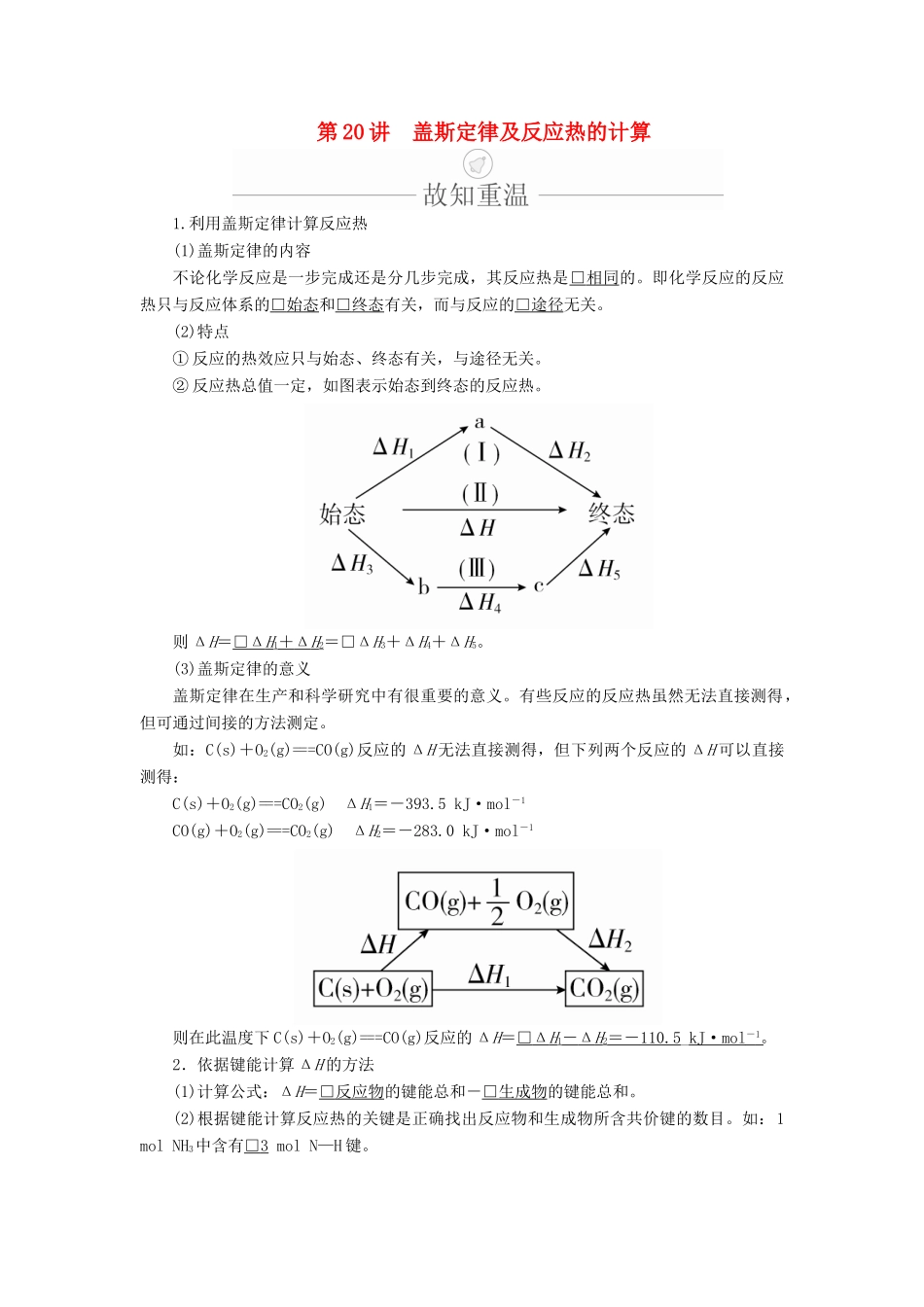
第20讲盖斯定律及反应热的计算1.利用盖斯定律计算反应热(1)盖斯定律的内容不论化学反应是一步完成还是分几步完成,其反应热是□相同的。即化学反应的反应热只与反应体系的□始态和□终态有关,而与反应的□途径无关。(2)特点①反应的热效应只与始态、终态有关,与途径无关。②反应热总值一定,如图表示始态到终态的反应热。则ΔH=□ΔH1+ΔH2=□ΔH3+ΔH4+ΔH5。(3)盖斯定律的意义盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。如:C(s)+O2(g)===CO(g)反应的ΔH无法直接测得,但下列两个反应的ΔH可以直接测得:C(s)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1CO(g)+O2(g)===CO2(g)ΔH2=-283.0kJ·mol-1则在此温度下C(s)+O2(g)===CO(g)反应的ΔH=□ΔH1-ΔH2=-110.5_kJ·mol-1。2.依据键能计算ΔH的方法(1)计算公式:ΔH=□反应物的键能总和-□生成物的键能总和。(2)根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的数目。如:1molNH3中含有□3molN—H键。1.判断正误,正确的画“√”,错误的画“×”,并指明错因。(1)C(石墨,s)===C(金刚石,s)ΔH>0,说明石墨比金刚石稳定。(√)错因:_______________________________________________(2)已知:500℃、30MPa下,N2(g)+3H2(g)2NH3(g)ΔH=-92.4kJ·mol-1;将1.5molH2和过量的N2在此条件下充分反应,放出热量46.2kJ。(×)错因:此反应是可逆反应,不能进行完全,1.5_mol_H2不能完全转化为NH3,放出的热量小于46.2_kJ。(3)2H2O(l)===2H2(g)+O2(g)的焓变ΔH>0。(√)错因:_________________________________(4)已知相同条件下2SO2(g)+O2(g)2SO3(g)ΔH1,反应2SO2(s)+O2(g)2SO3(g)ΔH2,则ΔH1>ΔH2。(×)错因:ΔH越小,放出的热量越多,固态SO2转化为SO3(g)时放出的热量应小于气态SO2转化为SO3(g),即ΔH1<ΔH2。(5)H2(g)+O2(g)===H2O(l)ΔH1和2H2(g)+O2(g)===2H2O(l)ΔH2中的ΔH1=ΔH2。(×)错因:ΔH的数值与方程式中的分子式前面的系数成正比,即ΔH2=2ΔH1。(6)H2(g)+O2(g)===H2O(g)ΔH1和H2O(g)===H2(g)+O2(g)ΔH2中的ΔH1=-ΔH2。(√)错因:______________________________2.教材改编题(据人教选修四P14T6)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃、101kPa时:4Fe(s)+3O2(g)===2Fe2O3(s)ΔH=-1648kJ·mol-1C(s)+O2(g)===CO2(g)ΔH=-393kJ·mol-12Fe(s)+2C(s)+3O2(g)===2FeCO3(s)ΔH=-1480kJ·mol-1FeCO3在空气中加热反应生成Fe2O3的热化学方程式是____________。答案4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)ΔH=-260kJ·mol-1考点盖斯定律及应用[典例1](2018·河南安鹤新开四校联考)工业上制取硝酸铵的流程图如下所示:――→――→――→――→请回答下列问题:已知:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g)ΔH=-1745.2kJ·mol-1;6NO(g)+4NH3(g)5N2(g)+6H2O(g)ΔH=-1925.2kJ·mol-1;则反应Ⅰ的热化学方程式可表示为_______________________。解析将已知的两个热化学方程式从上到下依次标记为①和②,根据盖斯定律由①×5-②×4得:4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH=-1025.2kJ·mol-1。答案4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH=-1025.2kJ·mol-1名师精讲利用盖斯定律计算反应热的一般步骤1.在298K、101kPa时,已知:①2H2O(g)===O2(g)+2H2(g)ΔH1②Cl2(g)+H2===2HCl(g)ΔH2③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3则ΔH3与ΔH1和ΔH2间的关系正确的是()A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH2答案A解析根据盖斯定律,由①+②×2可以得到③,故ΔH1+2ΔH2=ΔH3,A项正确。2.(2018·河南安鹤新开四校联考)用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)ΔH=+64.39kJ·mol-12H2O2(l)===2H2O(l)+O2(g)ΔH=-196.46kJ·mol-1H2(g)+O2(g)===H2O(l)ΔH=-285.84kJ·mol-1在H2SO4溶液中,Cu与H2O2反应生成Cu2+...