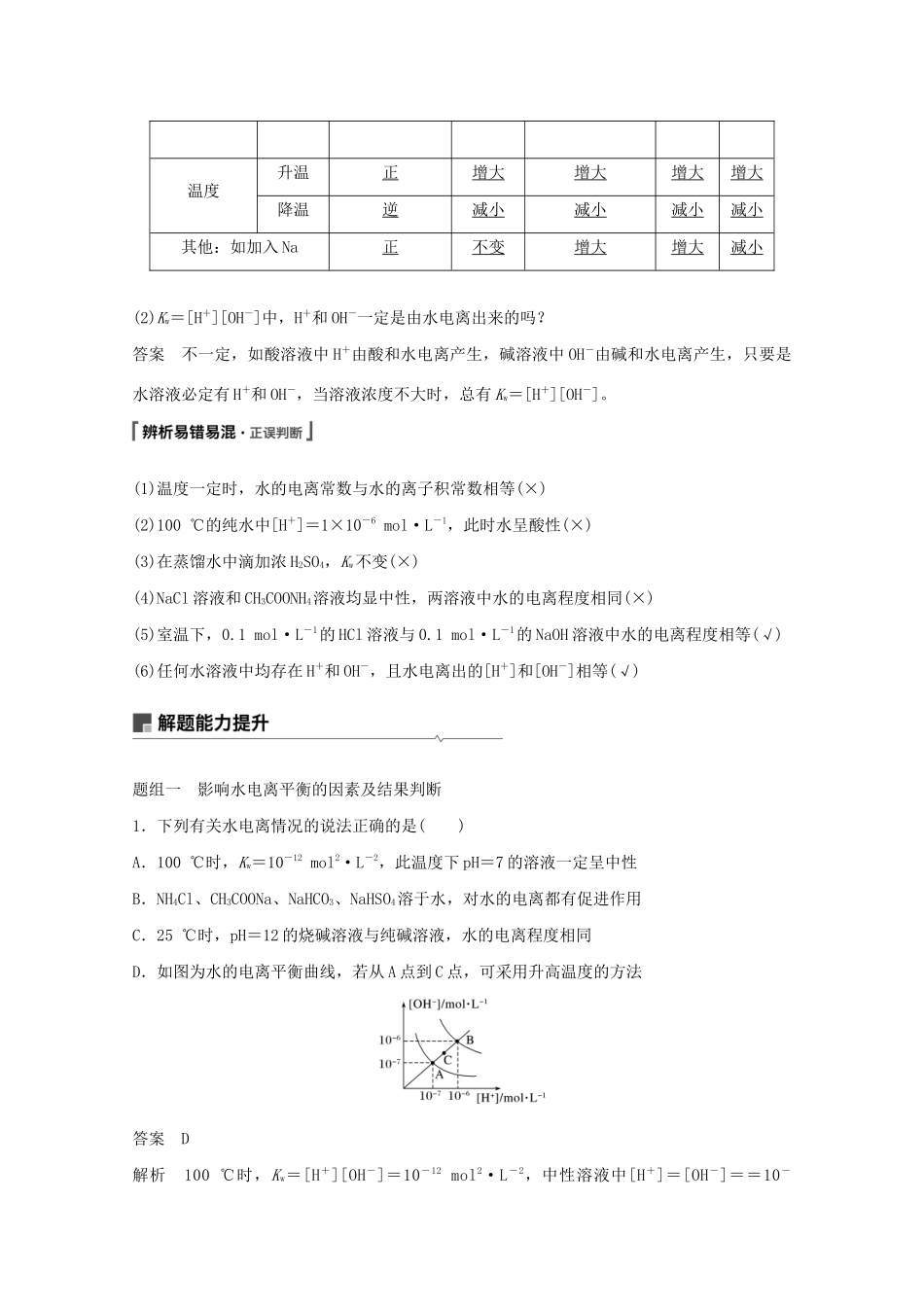
第25讲水的电离和溶液的pH目标要求1.认识水的电离,了解水的离子积常数,认识溶液的酸碱性及pH,掌握检测溶液pH的方法。2.能进行溶液pH的简单计算,能正确测定溶液的pH,能调控溶液的酸、碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。1.水的电离(1)水是极弱的电解质,其电离过程吸热(填“吸热”或“放热”)。水的电离平衡常数的表达式为K=。(2)影响水的电离平衡的因素①温度:温度升高,水的电离平衡向正方向移动,[H+]和[OH-]均增大(填“增大”“减小”或“不变”)。②加酸或碱会抑制(填“促进”或“抑制”)水的电离。③加能水解的盐,可与水电离出的H+或OH-结合,使水的电离平衡正向移动。2.水的离子积(1)表达式:Kw=[H+][OH-]。(2)影响因素:一定温度时,Kw是个常数,Kw只与温度有关,温度越高,Kw越大。25℃时,Kw=1×10-14mol2·L-2,100℃时,Kw=1×10-12mol2·L-2。(3)适用范围:Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液。理解应用(1)填写外界条件对水电离平衡的具体影响体系变化条件平衡移动方向Kw水的电离程度[OH-][H+]HCl逆不变减小减小增大NaOH逆不变减小增大减小可水解的盐Na2CO3正不变增大增大减小NH4Cl正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他:如加入Na正不变增大增大减小(2)Kw=[H+][OH-]中,H+和OH-一定是由水电离出来的吗?答案不一定,如酸溶液中H+由酸和水电离产生,碱溶液中OH-由碱和水电离产生,只要是水溶液必定有H+和OH-,当溶液浓度不大时,总有Kw=[H+][OH-]。(1)温度一定时,水的电离常数与水的离子积常数相等(×)(2)100℃的纯水中[H+]=1×10-6mol·L-1,此时水呈酸性(×)(3)在蒸馏水中滴加浓H2SO4,Kw不变(×)(4)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同(×)(5)室温下,0.1mol·L-1的HCl溶液与0.1mol·L-1的NaOH溶液中水的电离程度相等(√)(6)任何水溶液中均存在H+和OH-,且水电离出的[H+]和[OH-]相等(√)题组一影响水电离平衡的因素及结果判断1.下列有关水电离情况的说法正确的是()A.100℃时,Kw=10-12mol2·L-2,此温度下pH=7的溶液一定呈中性B.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用C.25℃时,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同D.如图为水的电离平衡曲线,若从A点到C点,可采用升高温度的方法答案D解析100℃时,Kw=[H+][OH-]=10-12mol2·L-2,中性溶液中[H+]=[OH-]==10-6mol·L-1,即pH=6,此温度下pH=7的溶液呈碱性,A项错误;NH4Cl、CH3COONa、NaHCO3促进水的电离,NaHSO4抑制水的电离,B项错误;烧碱是NaOH,抑制水的电离,纯碱是Na2CO3,促进水的电离,C项错误;图中A点到C点,[H+]与[OH-]同等程度增大,说明是温度升高的结果,D项正确。2.25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是()A.④>③>②>①B.②>③>①>④C.④>①>②>③D.③>②>①>④答案C解析②③分别为碱、酸,抑制水的电离;④中NH水解促进水的电离,①NaCl不影响水的电离。题组二计算电解质溶液中水电离出的[H+]或[OH-]3.(2020·西安检测)25℃时,在等体积的①pH=0的H2SO4溶液、②0.05mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是()A.1∶10∶1010∶109B.1∶5∶(5×109)∶(5×108)C.1∶20∶1010∶109D.1∶10∶104∶109答案A解析H2SO4与Ba(OH)2抑制水的电离,Na2S与NH4NO3促进水的电离。25℃时,pH=0的H2SO4溶液中:[H2O]电离=[OH-]=mol·L-1=10-14mol·L-1;0.05mol·L-1的Ba(OH)2溶液中:[H2O]电离=[H+]=mol·L-1=10-13mol·L-1;pH=10的Na2S溶液中:[H2O]电离=[OH-]=10-4mol·L-1;pH=5的NH4NO3的溶液中:[H2O]电离=[H+]=10-5mol·L-1。它们的物质的量之比为10-14∶10-13∶10-4∶10-5=1∶10∶1010∶109,故A正确。4.下表是不同温度下水的离子积数据:温度/℃25t1t2水的离子积常数/mol2·L-...