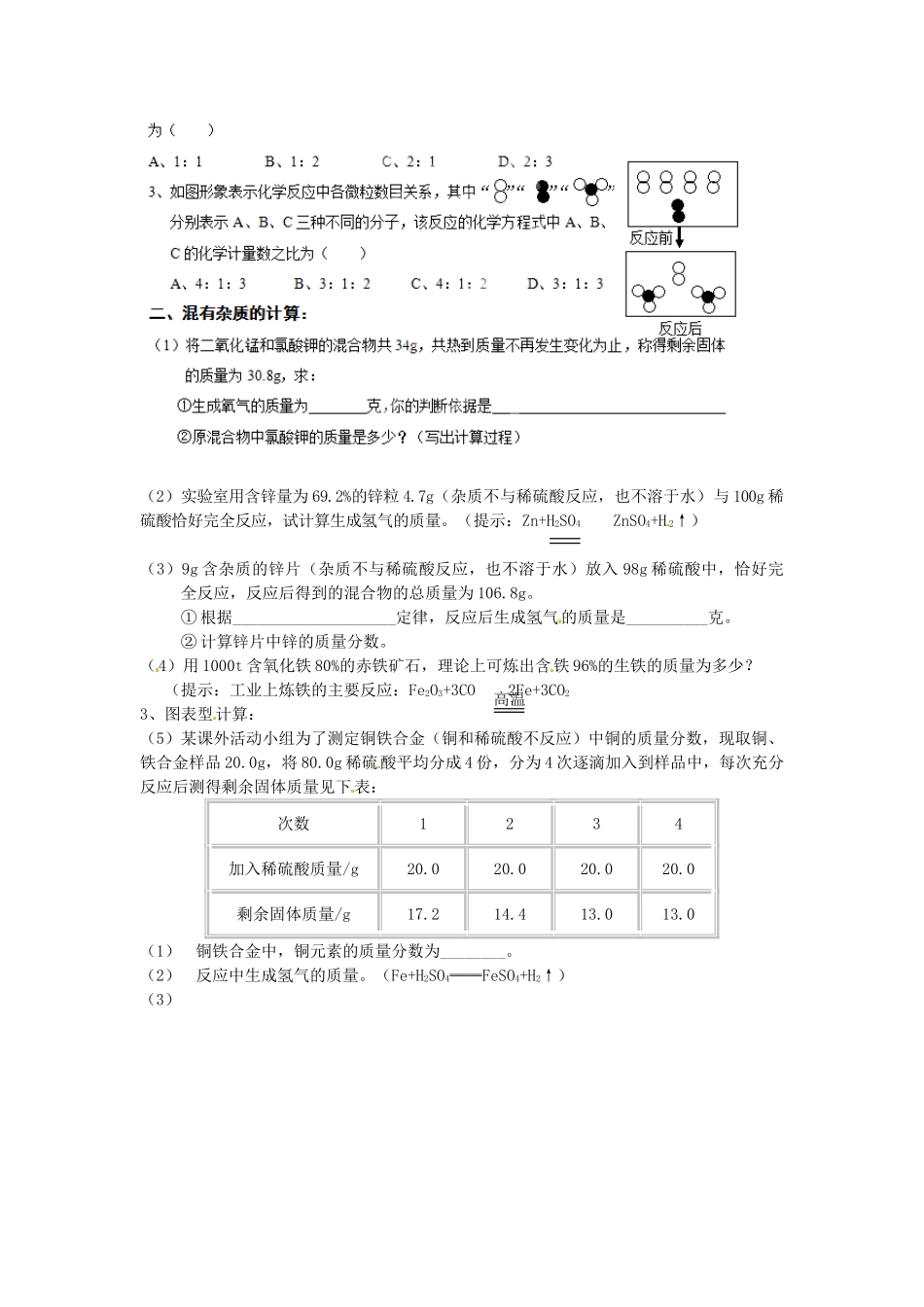
利用化学方程式的简单计算自主学习方案:一、我知道了:计算题基本题型有类型一:类型二:二、我能说出:解题的基本步骤。课堂导学方案一、我会计算和书写:可能用到的相对原子质量:C:12Al:27K:39Cl:35.5Zn:65S:32Fe:56练习1:实验室若要制得22.4升氧气(标况下氧气的密度为1.429g/L)至少需消耗氯酸钾的质量为多少?课后拓展学习方案一、常见选择题,填空题题型:1、碳在氧气中燃烧,下列说法符合质量守恒定律的是()A、2gC和4gO2生成6gCO2B、4gC和5gO2生成9gCO2C、5g和9gO2生成14gCO2D、3gC和8gO2生成11gCO22、在铝燃烧生成氧化铝的反应中,铝、氧气、氧化铝的质量比是()A、27:32:102B、27:24:43C、4:3:2D、108:96:2043、在反应A+2B=3C中,若15gA和B恰好完全反应生成45gC,则A与B相对分子质量比(2)实验室用含锌量为69.2%的锌粒4.7g(杂质不与稀硫酸反应,也不溶于水)与100g稀硫酸恰好完全反应,试计算生成氢气的质量。(提示:Zn+H2SO4ZnSO4+H2↑)(3)9g含杂质的锌片(杂质不与稀硫酸反应,也不溶于水)放入98g稀硫酸中,恰好完全反应,反应后得到的混合物的总质量为106.8g。①根据____________________定律,反应后生成氢气的质量是__________克。②计算锌片中锌的质量分数。(4)用1000t含氧化铁80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量为多少?(提示:工业上炼铁的主要反应:Fe2O3+3CO2Fe+3CO23、图表型计算:(5)某课外活动小组为了测定铜铁合金(铜和稀硫酸不反应)中铜的质量分数,现取铜、铁合金样品20.0g,将80.0g稀硫酸平均分成4份,分为4次逐滴加入到样品中,每次充分反应后测得剩余固体质量见下表:次数1234加入稀硫酸质量/g20.020.020.020.0剩余固体质量/g17.214.413.013.0(1)铜铁合金中,铜元素的质量分数为________。(2)反应中生成氢气的质量。(Fe+H2SO4══FeSO4+H2↑)(3)高温