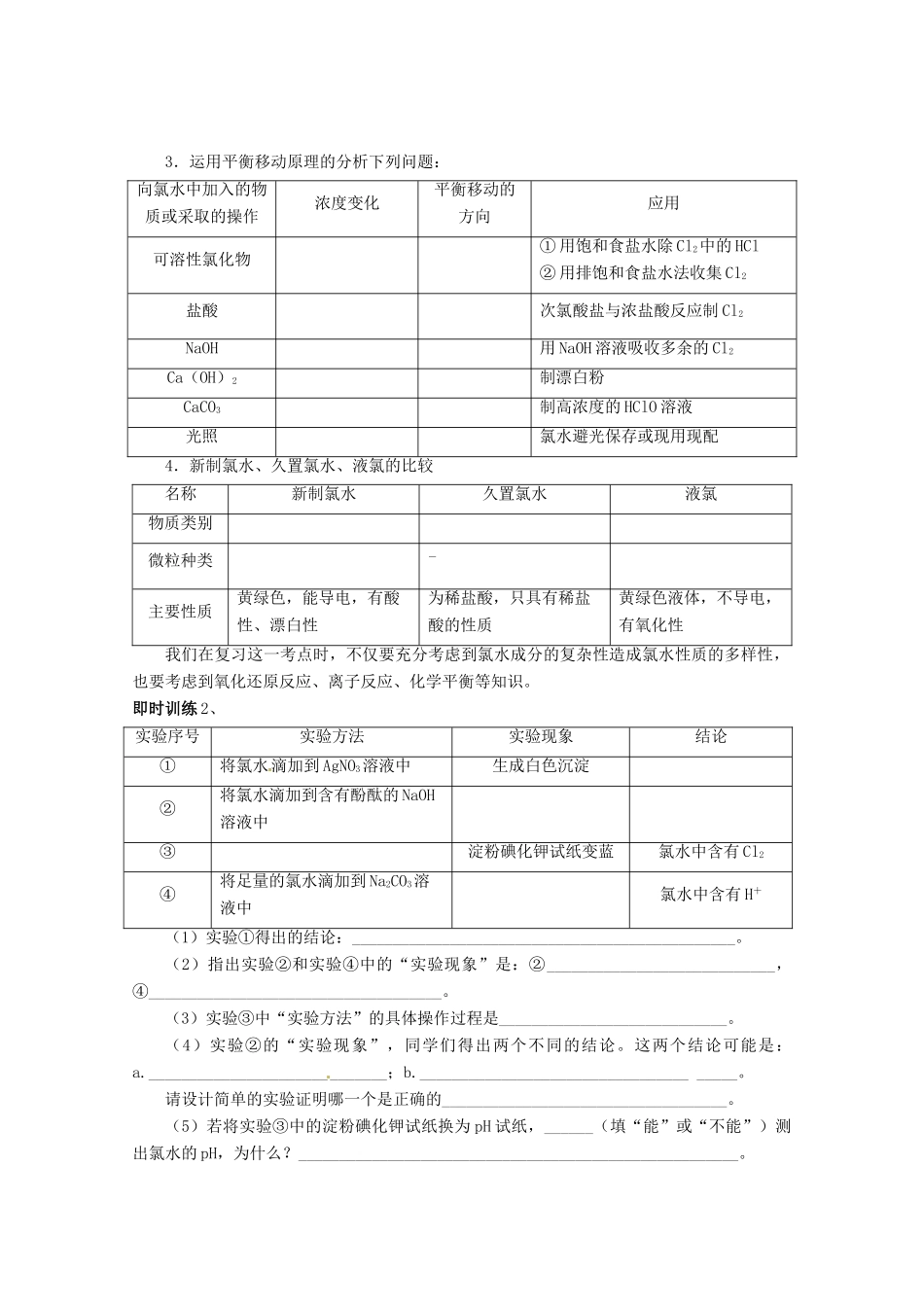
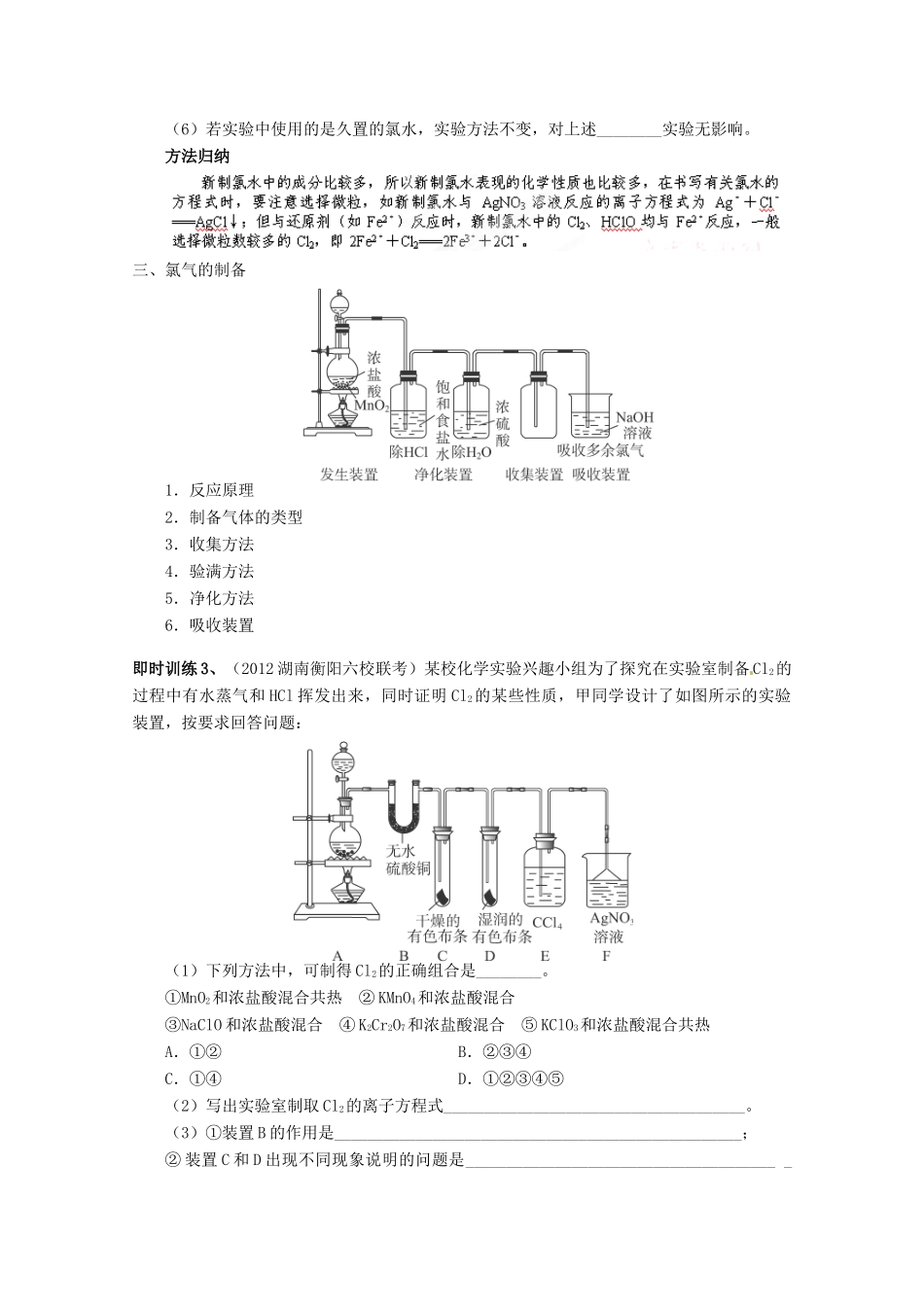
湖北省武汉市蔡甸区第二中学高中化学必修1《第二节富集在海水中的元素——氯》导学案1、氯气的性质及应用,特别是它的强氧化性和漂白性;2、实验室制取氯气的原理、干燥、收集及验满等,以它为载体,考查实验探究能力;3、氯离子的检验。一、氯气的性质1.物理性质氯气是一种________色气体,具有强烈的刺激性气味,密度比空气________(可用向________排空气法收集),能溶于水(1体积水约可溶解2体积的氯气)。氯气________毒。2.化学性质小结:①氯气的化学性质比较活泼,几乎能与所有金属反应,且一般是把金属氧化到________态。②燃烧不一定要有氧气参加,任何剧烈的发光放热的氧化还原反应都属于燃烧。③与NaOH溶液反应通常应用于制取漂白液,及氯气的尾气处理。与Ca(OH)2溶液反应的重要应用是工业上制取漂白粉与漂粉精。二者的主要成分都是______,有效成分是。即时训练1、下列说法中正确的是________。①氯原子最外层为7个电子,极易得电子达到“8电子稳定结构”,表现为强氧化性,所以氯气在反应中只作氧化剂②氯气具有漂白性③燃烧一定有氧气参加④氯气与铁反应生成三价铁⑤氯气通入NaBr溶液中,溶液由无色变为浅绿色⑥氯气可以用排饱和食盐水法收集⑦可用排水法收集氯气⑧氯气是黄绿色的,Cl-是无色的特别提示:(1)氯气本身不具有漂白性,氯气使有色物质褪色的实质是氯气与水反应生成的HClO有漂白作用。(2)氯原子的半径比较小,最外层有7个电子,易得1个电子使最外层达到8电子的稳定结构,故氯气的化学性质比较活泼,是一种常见的强氧化剂,但氯气与水、碱反应时,既表现氧化性又表现还原性。(3)我们中学阶段常见有颜色的气体有Cl2、NO2,有毒气体有Cl2、NO2、NO、CO、SO2、H2S。二、氯水的成分和性质1.氯水的成分2.氯水的性质3.运用平衡移动原理的分析下列问题:向氯水中加入的物质或采取的操作浓度变化平衡移动的方向应用可溶性氯化物①用饱和食盐水除Cl2中的HCl②用排饱和食盐水法收集Cl2盐酸次氯酸盐与浓盐酸反应制Cl2NaOH用NaOH溶液吸收多余的Cl2Ca(OH)2制漂白粉CaCO3制高浓度的HClO溶液光照氯水避光保存或现用现配4.新制氯水、久置氯水、液氯的比较名称新制氯水久置氯水液氯物质类别微粒种类-主要性质黄绿色,能导电,有酸性、漂白性为稀盐酸,只具有稀盐酸的性质黄绿色液体,不导电,有氧化性我们在复习这一考点时,不仅要充分考虑到氯水成分的复杂性造成氯水性质的多样性,也要考虑到氧化还原反应、离子反应、化学平衡等知识。即时训练2、实验序号实验方法实验现象结论①将氯水滴加到AgNO3溶液中生成白色沉淀②将氯水滴加到含有酚酞的NaOH溶液中③淀粉碘化钾试纸变蓝氯水中含有Cl2④将足量的氯水滴加到Na2CO3溶液中氯水中含有H+(1)实验①得出的结论:_______________________________________________。(2)指出实验②和实验④中的“实验现象”是:②____________________________,④____________________________________。(3)实验③中“实验方法”的具体操作过程是____________________________。(4)实验②的“实验现象”,同学们得出两个不同的结论。这两个结论可能是:a._____________________________;b.______________________________________。请设计简单的实验证明哪一个是正确的___________________________________。(5)若将实验③中的淀粉碘化钾试纸换为pH试纸,______(填“能”或“不能”)测出氯水的pH,为什么?______________________________________________________。(6)若实验中使用的是久置的氯水,实验方法不变,对上述________实验无影响。方法归纳三、氯气的制备1.反应原理2.制备气体的类型3.收集方法4.验满方法5.净化方法6.吸收装置即时训练3、(2012湖南衡阳六校联考)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置,按要求回答问题:(1)下列方法中,可制得Cl2的正确组合是________。①MnO2和浓盐酸混合共热②KMnO4和浓盐酸混合③NaClO和浓盐酸混合④K2Cr2O7和浓盐酸混合⑤KClO3和浓盐酸混合共热A....