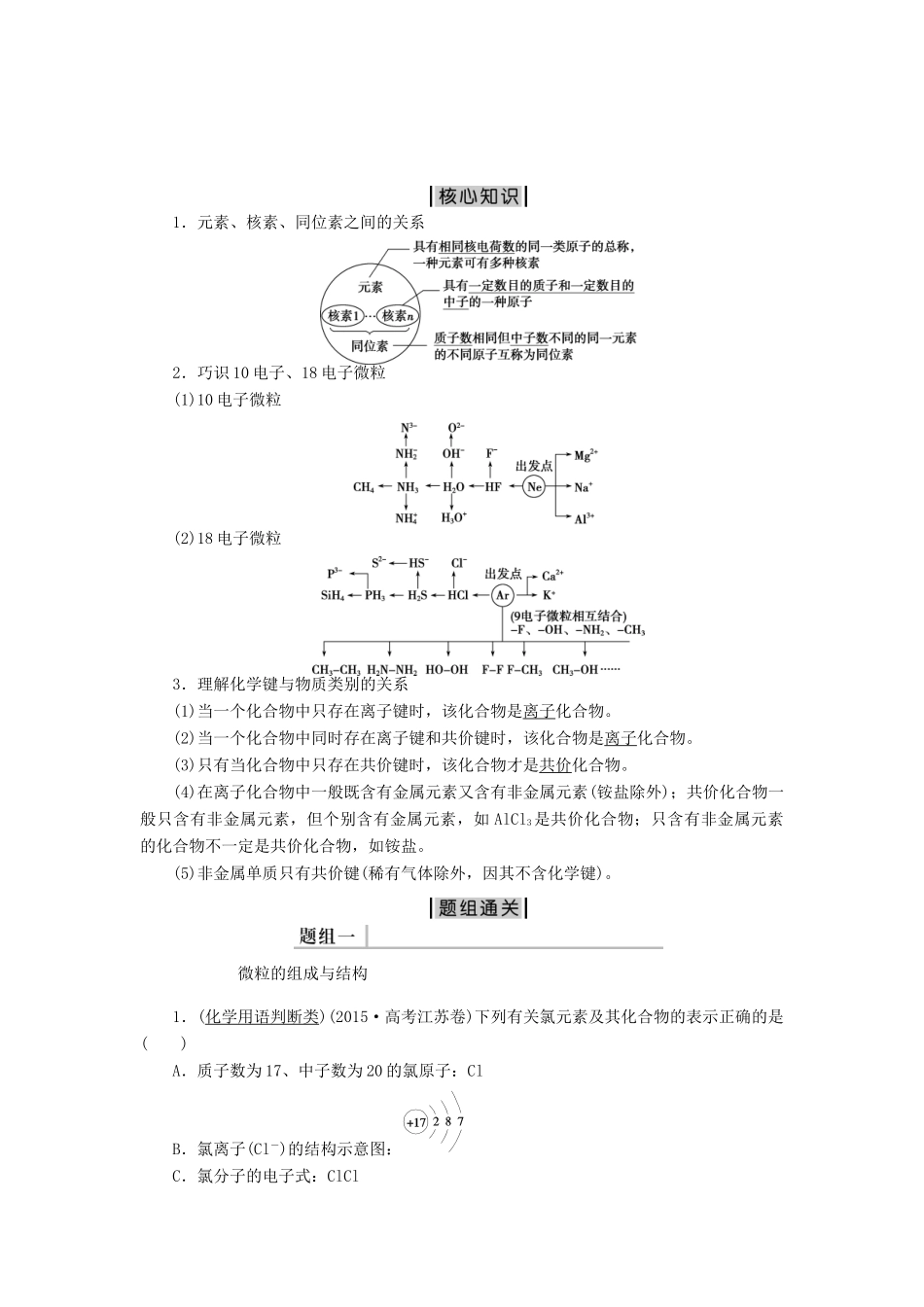
专题二基本理论第四讲物质结构与元素周期律2016高考导航——适用于全国卷Ⅰ最新考纲高频考点高考印证命题趋势1.了解元素、核素和同位素的含义。2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.了解原子核外电子排布。4.掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。5.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。6.以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。7.了解金属、非金属在元素周期表中的位置及其性质递变的规律。8.了解化学键的定义。了解离子键、共价键的形成。9.以上各部分知识的综合应用。原子结构和化学键2014·T102013·T91.高考对原子结构的考查常从以下角度进行:(1)构成原子的粒子及各粒子之间的关系,以及质子数、中子数、电子数与元素、原子、同位素、原子序数、质量数等概念之间的联系。(2)对1~18号元素的核外电子排布规律的考查,通常与元素的性质及其在周期表中的位置结合起来综合考查。2.近几年高考试题中,本讲内容在选择题中出现的几率非常大,其考查形式一般为以元素在周期表中的相对位置、原子结构特点以及元素的某些特性为元素推断的起点,考查内容涉及元素周期律的主要内容,综合性较强。元素周期律和元素周期表2015·T122014·T10元素的推断2015·T122013·T9,考点一原子结构和化学键[学生用书P15]1.元素、核素、同位素之间的关系2.巧识10电子、18电子微粒(1)10电子微粒(2)18电子微粒3.理解化学键与物质类别的关系(1)当一个化合物中只存在离子键时,该化合物是离子化合物。(2)当一个化合物中同时存在离子键和共价键时,该化合物是离子化合物。(3)只有当化合物中只存在共价键时,该化合物才是共价化合物。(4)在离子化合物中一般既含有金属元素又含有非金属元素(铵盐除外);共价化合物一般只含有非金属元素,但个别含有金属元素,如AlCl3是共价化合物;只含有非金属元素的化合物不一定是共价化合物,如铵盐。(5)非金属单质只有共价键(稀有气体除外,因其不含化学键)。微粒的组成与结构1.(化学用语判断类)(2015·高考江苏卷)下列有关氯元素及其化合物的表示正确的是()A.质子数为17、中子数为20的氯原子:ClB.氯离子(Cl-)的结构示意图:C.氯分子的电子式:ClClD.氯乙烯分子的结构简式:H3C—CH2Cl[破题关键]核素的表示式X中,左上角A表示质量数,左下角Z表示质子数;注意离子与原子的结构示意图的差异;在有机物的结构简式中要突出官能团。解析:选C。A选项,氯原子符号左上角的数据应是质量数,其质量数为37,所以错误;B选项,氯离子的最外层电子数应为8,所以错误;C选项,电子式表示符合要求,所以正确;D选项,结构简式表示的是氯乙烷而不是氯乙烯,所以错误。[互动拓展](1)符号X的含义是什么?A和Z之间有什么关系?决定元素种类的微粒是什么?(2)核素、同位素、同素异形体描述的对象有何不同?答案:(1)X表示一个质量数为A、质子数为Z的X原子,且A=Z+N(N表示中子数);元素是具有相同质子数(核电荷数)的同一类原子的总称,故质子数(核电荷数)决定了元素的种类。(2)核素是具有一定数目质子和一定数目中子的一种原子,同位素是质子数相同而中子数不同的同一种元素的不同原子,故它们描述的对象都是原子;同素异形体是同种元素形成的不同单质,描述对象是单质。判断下列说法是否正确。(1)NaHCO3、HCOONa均含有离子键和共价键。()(2)ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物。()(3)CO2分子中的化学键为非极性键。()(4)(2014·高考山东卷)Cl与Cl得电子能力相同。()答案:(1)√(2)√(3)×(4)√2.下列说法中正确的是()A.34S原子核内的中子数为16B.1H和2H的化学性质相同C.HO与HO互为同素异形体D.Na和Na+属于同种元素,且性质相同解析:选B。34S原子核内的中子数为18,质子数为16;同素异形体是指同种元素形成的不同单质;Na和Na+属于同种元素,但二者性质不同。(1)同种元素,可以有若干种不同的核素,即核素种类远大于元素种类。(2)元素有多少种核素,就有多少种原子。(3)同位素是同一元素不同...