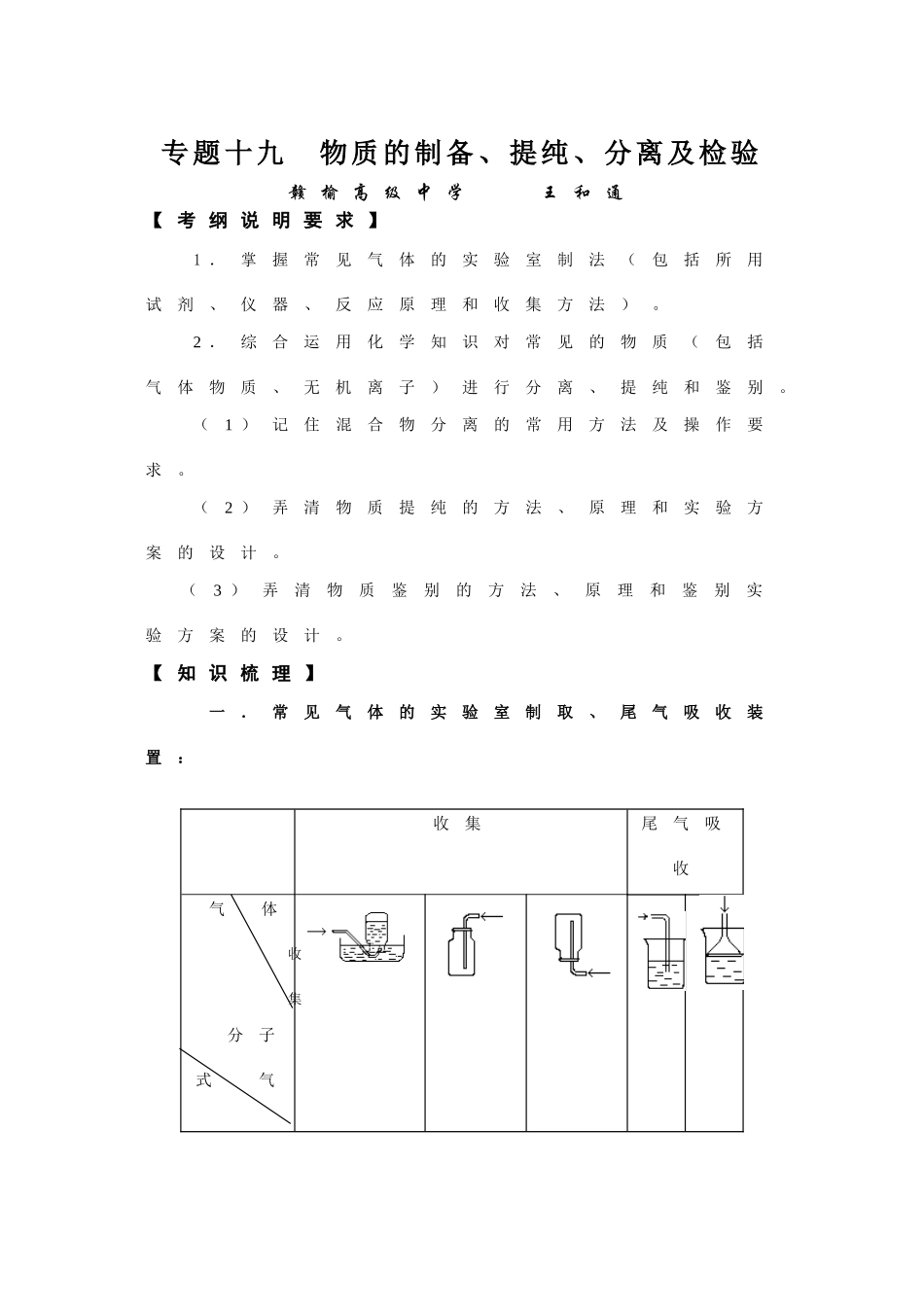
专题十九物质的制备、提纯、分离及检验赣榆高级中学王和通【考纲说明要求】1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。2.综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别。(1)记住混合物分离的常用方法及操作要求。(2)弄清物质提纯的方法、原理和实验方案的设计。(3)弄清物质鉴别的方法、原理和鉴别实验方案的设计。【知识梳理】一.常见气体的实验室制取、尾气吸收装置:收集尾气吸收气体收集分子式气体制取气体的装置二、物质的分离与提纯方法固-固分离:;固-液分离:;液-液分离:;气-气分离:。混合物的化学分离法方法热分解法沉淀分离酸碱分离水解分离氧化还原常见物质的提纯与分离方法法法法法实例三、物质的检验检验类型鉴别利用不同物质的性质差异,通过实验,将它们区别开来。鉴定根据物质的特性,通过实验,检验出该物质的成分,确定它是否是这种物质。推断根据已知实验及现象,分析判断,确定被检的是什么物质,并指出可能存在什么,不可能存在什么。检验方法①若是固体,一般应先用蒸馏水溶解②若同时检验多种物质,应将试管编号③要取少量溶液放在试管中进行实验,绝不能在原试剂瓶中进行检验④叙述顺序应是:实验(操作)→现象→结论→原理(写方程式)【典型例题】例1.实验室用下列方法制备有关物质,其中合理的是()A.过氧化钠与水反应制氧气B.乙醇和醋酸混合共热制乙酸乙酯C.碳酸钙与稀硫酸制二氧化碳D.亚硫酸钠与浓硝酸制二氧化硫例2.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确,且最后能得到纯净物质的是()选项被提纯的物质除杂试剂分离方法A溴化钠溶液(NaI)氯水、CCl4萃取、分液B氯化铵溶液(FeCl3)氢氧化钠溶液过滤C二氧化碳(CO)氧化铜粉末通过灼热的CuO粉末D苯(苯酚)浓溴水过滤例3.下列各组物质用一种试剂不能加以鉴别的是()A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液B.苯、苯酚溶液、已烯和乙醇C.Na2SO4溶液、Na2SO3溶液、Na2CO3溶液、NaAlO2溶液D.NaCl溶液、NH4Cl溶液、(NH4)2SO4溶液、Na2SO4溶液例4.实验室一般用回收的铜屑与硫酸---硝酸混合溶液反应制备CuSO4.5H2O晶体,反应可在下图中进行。反应方程式为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O(1)A中的浓硝酸不能一次加入的原因是(2)C装置的作用是(3)D装置中的次氯酸钠溶液(含有NaOH)用来吸收尾气,吸收液与尾气发生化学反应的方程式为。下列溶液中能够代替次氯酸钠吸收尾气的是A.碘水B.硝酸C.酸性高锰酸钾D.氯化钠(4)欲得到不含Cu(NO3)2的硫酸铜晶体,应采取的措施是(5)反应完成后将溶液水浴加热浓缩,冷却析出CuSO4.5H2O晶体,采用水浴加热的目的是。DCBA【针对性练习】1下列反应适用于实验室制备氧气的是()①高锰酸钾热分解2KMnO4K2MnO4+MnO2+O2↑②硝酸铵热分解2NH4NO34H2O+N2↑+O2↑③过氧化氢催化分解2H2O22H2O+O2↑④二氧化氮热分解2NO22NO+O2↑A.只有①B.①和②C.①和③D.①③④2按下列实验方法制备气体,合理而又实用的是()A.锌粒与稀硝酸反应制备H2B.向饱和氯化钠溶液中滴加稀硫酸制备HClC.亚硫酸钠与浓硫酸反应制备SO2D.大理石与浓硫酸反应制备CO23下图是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是(填正确选项的标号)A.铜屑和浓硝酸B.二氧化锰和浓盐酸C.电石和水D.碳酸钙和稀盐酸4某无色混合气体可能含有CO2、CO、H2O(水蒸气)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,溶液变得浑浊。由此可以确定混合气体中()A.一定含有CO2、H2O,至少含有H2、CO中的一种B.一定含有H2O、CO,至少含有CO2、H2中的一种C.一定含有CO、CO2,至少含有H2O、H2、中的一种D.一定含有CO、H2,至少含有H2O、CO2中的一种5如果只有烧碱、盐酸、大理石、硝酸钠、铜片、蒸馏水,从欠缺试剂的角度看,无法进行的实验项目是()A.制纯碱B.制氯化铜C.制氢...