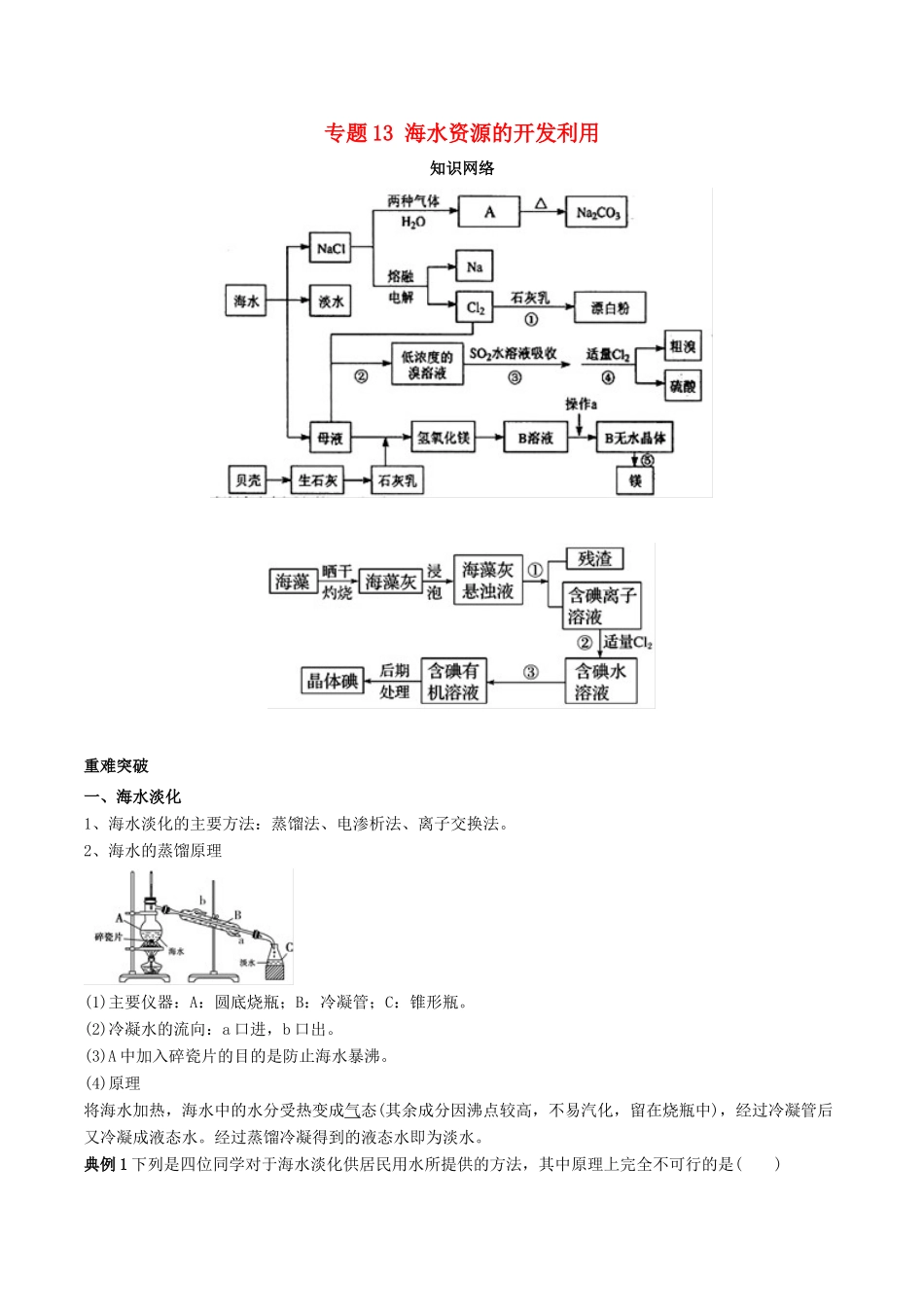
专题13海水资源的开发利用知识网络重难突破一、海水淡化1、海水淡化的主要方法:蒸馏法、电渗析法、离子交换法。2、海水的蒸馏原理(1)主要仪器:A:圆底烧瓶;B:冷凝管;C:锥形瓶。(2)冷凝水的流向:a口进,b口出。(3)A中加入碎瓷片的目的是防止海水暴沸。(4)原理将海水加热,海水中的水分受热变成气态(其余成分因沸点较高,不易汽化,留在烧瓶中),经过冷凝管后又冷凝成液态水。经过蒸馏冷凝得到的液态水即为淡水。典例1下列是四位同学对于海水淡化供居民用水所提供的方法,其中原理上完全不可行的是()【答案】A【解析】海水淡化的方法:蒸馏法、电渗析法、离子交换法。选项A,明矾的主要成分是KAl(SO4)2·12H2O,加明矾不能使海水中的盐沉淀出来,所以不能使海水淡化。典例2下列各组物质,不需要经过化学变化就能够从海水中获得的是()A.氯、溴、碘B.钠、镁、铝C.烧碱、氢气D.食盐、淡水【答案】D【解析】海水经过蒸发可得到食盐和淡水。A、B选项中,海水中存在Cl-、Br-、I-、Na+、Mg2+、Al3+,要获得它们的单质必须失去或得到电子才能实现。C中,需要电解饱和食盐水获取。【总结提升】海水淡化的方法和原理方法原理蒸馏法将海水加热至沸腾汽化,然后将蒸气冷凝而得到蒸馏水电渗析法在外加直流电场作用下,利用阴、阳离子交换膜对水中阴、阳离子的选择透过性,使水中的一部分离子转移到另一部分水中而达到除盐的目的离子交换法用阳离子交换树脂和阴离子交换树脂除去海水中的阴、阳离子,得到去离子水二、海水中提取Mg海水提镁的生产流程可表示为海水提取镁的最基本方法是往海水中加碱,得到_氢氧化镁沉淀,将沉淀分离出来后再加入盐酸把它变成氯化镁;之后,经过结晶、过滤、干燥、电解,就可得到金属镁。典例3从海水中可提取多种化工原料,下面是工业上对海水资源综合利用的示意图。试回答下列问题:(1)粗盐中含有Ca2+、Mg2+、SO等杂质离子,精制时所用试剂为A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。则加入试剂的顺序是________(填字母)。(2)写出用海滩上的贝壳制Ca(OH)2的化学方程式:_________________________________。(3)电解无水MgCl2可制取镁和Cl2,其中副产品Cl2和Ca(OH)2可制得漂白粉。制漂白粉的化学方程式为__________________________________。(4)用海滩上的贝壳制Ca(OH)2,而不从异地山中开凿石灰石制取,主要考虑到什么问题?_______________________________________________________________。(5)从经济效益角度看,该化工厂厂址应选在__________________________________。【答案】(1)BCDA(或CBDA)(2)CaCO3=====CaO+CO2↑,CaO+H2O===Ca(OH)2(3)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(4)经济效益(5)海边【解析】化工生产是综合利用化学知识解决实际问题的过程,在此过程中,除运用到我们所学的化学知识外,还要从环境保护、能源利用、经济效益等方面考虑。(1)该小题属离子除杂题。除杂原则是在除去Ca2+、Mg2+、SO时,不能带入新的杂质离子。所以,解此题的关键是把握好加入离子的顺序:①Ba2+必须在CO之前加入;②CO、OH-必须在H+之前加入,所以B、C不分先后,而D、A本身既分先后,A又必须放在B、C之后才能满足条件。(2)由贝壳→Ca(OH)2的反应为CaCO3→CaO→Ca(OH)2。(3)漂白粉的主要成分为CaCl2和Ca(ClO)2,可将Cl2通入石灰乳中制得。(4)海滩上的物质为海水综合利用创造了便利条件,不用运输,就地取材,从经济效益角度考虑是有利的。(5)由此可见,应在海滩建化工厂或在沿海陆地建厂。三、海水中制取溴、碘1、海水提溴主要方法:空气吹出法。海水提溴四个过程2、海带中提碘(1)海带中含有碘元素的检测(2)海带中提碘①流程海带―→晒干、灼烧―→浸泡―→过滤―→氧化―→提纯―→碘单质②主要的化学原理:2H++2I-+H2O2===I2+2H2O或Cl2+2KI===2KCl+I2。典例4工业上海水资源合理开发利用的部分工艺流程如图所示:(1)该工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?______(填“能”或“不能”),原因是_______________________________________。(2)溴单质在四氯化碳中的溶解度比其在水...