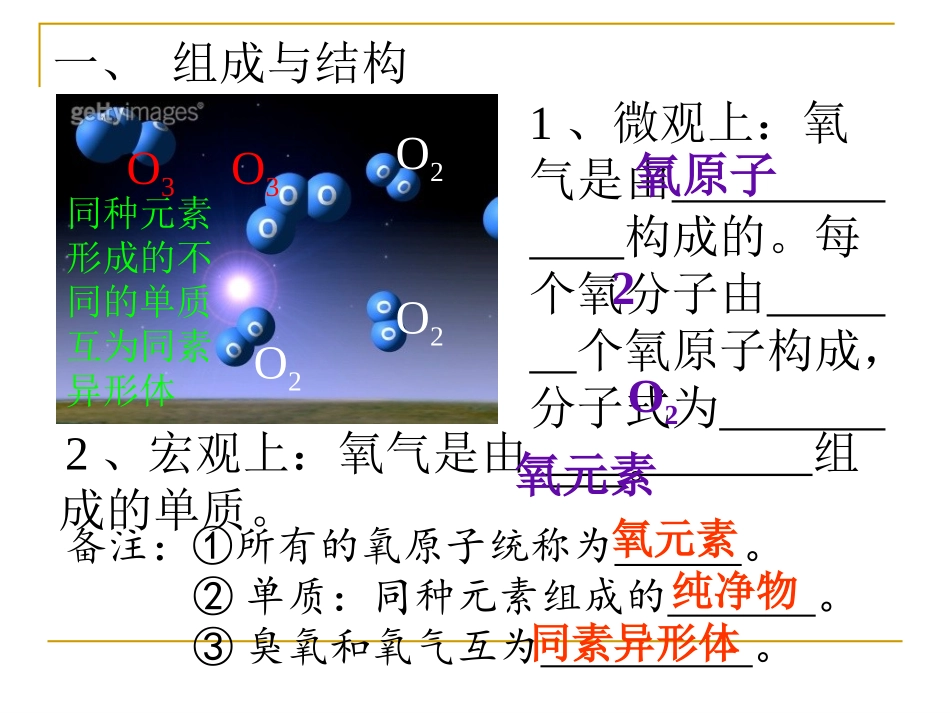
常见金属元素的名称及符号的记忆?名称符号名称氢符号H名称符号钾钙钠镁铝锌铁锡铅铜汞银铂金KCaNaMgAlZnFeSnPbCuHgAgPtAu一、组成与结构O3O3O2O2O21、微观上:氧气是由构成的。每个氧分子由个氧原子构成,分子式为。氧原子2O22、宏观上:氧气是由组成的单质。氧元素备注:①所有的氧原子统称为。②单质:同种元素组成的。③臭氧和氧气互为。氧元素纯净物同素异形体同种元素形成的不同的单质互为同素异形体二、氧气的物理性质①;(色态味)②;(相对密度)③;(水溶性)④。(储存和运输)无色无味的气体比空气的密度略大不易溶于水淡蓝色的液、固体三、氧气的化学性质1.木炭在氧气中燃烧现象:方程:①在空气中发红,在氧气中发明亮的白光;②放出大量的热;③产生的气体能使澄清的石灰水变浑浊。C+O2==CO2点燃三、氧气的化学性质2.硫在氧气中燃烧现象:方程:①在空气发出微弱的淡蓝色火焰,在氧气中发明亮的蓝紫色火焰;②放出大量的热;③产生有刺激性气味的气体。S+O2==SO2点燃留水?吸收有毒的SO2三、氧气的化学性质3.磷在氧气中燃烧现象:方程:①发明亮的黄色火焰;②放出大量的热;③产生浓厚的白烟。4P+5O2==P2O5点燃留水?防止熔化物炸裂瓶底三、氧气的化学性质4.铁丝磷在氧气中燃烧现象:方程:①火星四射;②放出大量的热;③生成黑色固体。3Fe+2O2==2Fe3O4点燃留水?防止熔化物炸裂瓶底三、氧气的化学性质5.镁条在空气中燃烧现象:方程:①发出耀眼白光;②放出大量的热;③生成白色固体。2Mg+O2==2MgO点燃三、氧气的化学性质6.铜丝在氧气中加热现象:方程:铜丝表面变黑2Cu+O2==2CuO△常用于除去混合气体中的O2小结①氧气的特性:。②氧气是一种化学性质活泼的气体,能与许多物质发生反应,同放出大量的。氧气的化学性质可概括两点:一是;二是。能使带火星的木条复燃比较氧化热供给呼吸支持燃烧三、氧气的化学性质四、实验室制法——分解过氧化氢1、反应原理:2H2O2==2H2O+O2↑MnO22、发生装置:优点:一是控制反应速率;二是节约药品。固液不加热装置液封!3、收集方法:√√×√√当气泡连续均匀时,才收集。优点:“较纯净”优点:“便储气”优点:可测定气体的体积。送气要到底优点:“较干燥”若要更干燥的氧气,则需先通过浓硫酸浓硫酸O2(H2O)O2排水法或向上排空气法正放4、检验方法:用带火星的木条,检验伸入瓶中,验满只在瓶口。四、实验室制法——加热氯酸钾1、反应原理:2KClO3==2KCl+3O2↑△MnO2灯内酒精要适量先匀后定用外熖中上部管口要略向下倾斜,以免冷凝水回流炸裂试管。对比450-600的夹角装置名称:加热固体型四、实验室制法——加热高锰酸钾1、反应原理:暗紫色固体紫色溶液2KMnO4==K2MnO4+MnO2+O2↑△2、发生装置:塞一团棉花,防止KMnO4粉末进入导管。主要步骤:“查”→“”→“”→“”→“”→“”→“”装定点收离熄注意:①H2O2溶液为色溶液俗称“”,医疗上常用于。H2O2溶液不用催化剂常温下也分解,而且随着温度的升高而加快,所以H2O2溶液必须保存。②氯酸钾为色粉末,不用催化剂加热也分解,只不过所需要的温度更高,分解的速度太慢。③高锰酸钾为色固体,稍微加热就分解,而且产生大量的高锰酸钾粉未,为防止高锰酸钾粉未进入集气瓶,要在试管口塞上。无双氧水消毒密封白暗紫一团棉花④加热氯酸钾、高锰酸钾制氧气的主要步骤:“查”→“”→“”→“”→“”→“”→“”装定点收离熄谐音:茶庄定点收利息。⑤催化剂又称“”,催化剂有“一变二不变”。“一变”:。加快反应速率的叫正催化剂,减慢反应速率的叫负催化剂。“二不变”:和不变。触媒改变其它物质的化学反应速率质量化学性质a.普通催化剂有“针对性”:如不能单说二氧化锰是催化剂,只能说二氧化锰可作××反应的催化剂。b.普通催化剂有“灵活性”:如二氧化锰、硫酸铜溶液可作过氧化氢分解的催化剂外,、、、等均可加快过氧化氢分解的速率。c.生物催化剂有“专一性”:一种酶只能催化一种反应。(酶——“掌握生命活动的物质”!)CuO铁锈红砖粉水泥块工业上所需大量氧气常采用方法制取,属于变化。五、氧气的工业制法分离空气物理1、化合反应。(多变一):的...