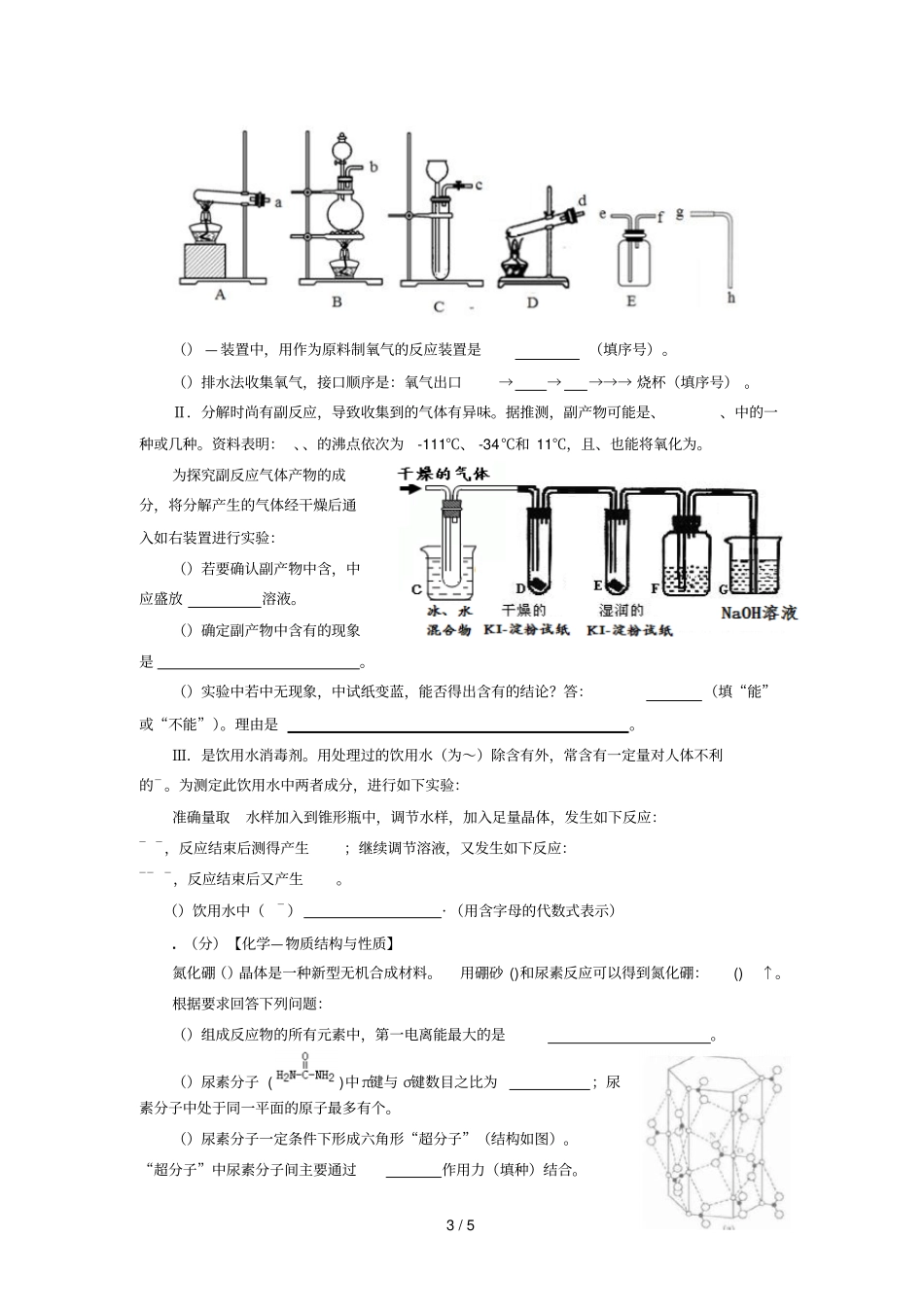
1/5福建省龙岩市届月高三质检化学试卷和答案.既能用浓硫酸又能用碱石灰干燥的是.....在的条件下能大量共存的是().,,,—.,,,—.,,,()—.,,—,—.化合物(分子式为)具有如下性质:→慢慢产生气泡;乙酸→有香味产物。以下判断正确的是.的结构简式为.香味产物分子式为.可以通过加成反应制得.、和乙酸均能与烧碱溶液反应.下列根据化学事实进行的相关推论,正确的是化学事实推论某一反应需要在高温条件下才能进行该反应的△>无色试液加入氢氧化钙溶液产生白色沉淀试液含有铁的氧化物用硝酸溶解后加入,溶液呈红色氧化物中铁元素为价少量通入溶液时反应为:电离常数:()>().科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其>,然后加入适量的铝粉、搅拌,从而实现预期目的。下列判断错误..的是.废水处理时铝单质转化为.废水处理中,亚硝酸盐被还原.处理过程中,参与了反应.铝粉颗粒大小影响废水处理的速率.硫代硫酸钠()溶液与盐酸混合,生成单质硫并沉淀出来。但若将硫代硫酸钠溶液先与界面活性剂(不参与反应)均匀混合于烧杯中,再加入盐酸溶液并立刻搅拌均匀,静置后无沉淀产生,得到含硫单质的胶体(硫分散在体系中)。下列叙述错误..的是.界面活性剂控制了硫生成的速率.烧杯中单质硫颗粒直径约为10-9-10-7m.硫代硫酸钠与盐酸反应中,盐酸作氧化剂.用平行光照射烧杯中液体,将观察到光的“通路”.用某浓度溶液滴定一元酸的滴定曲线如图所示(横坐标为滴入的体积,纵坐标为所得混合液的;甲基橙变色范围为)。下列判断正确的是.的浓度为×·.实验时可选甲基橙作指示剂.,酸碱恰好中和.时,溶液中()>(—).(分)2/5Ⅰ.短周期元素、、、在元素周期表中相对位置如图所示,其中所处的周期序数与族序数相等。按要求回答下列问题:()写出的原子结构示意图。()列举一个事实说明非金属性强于:(用化学方程式表示)。()含的某种盐常用作净水剂,其净水原理是(用离子方程式表示)。Ⅱ.运用所学化学原理,解决下列问题:()已知:++=+↑。某同学利用单质硅和镁为电极材料设计原电池(为电解质溶液),该原电池负极的电极反应式为;()已知:①()()()△·,②()()()△·③()()()△·。工业上生产粗硅的热化学方程式为;()已知:()()()()。右表为该反应在不同温度时的平衡常数。则:该反应的Δ(填“<”或“>”);℃时进行该反应,且和起始浓度相等,平衡转化率为。.(分)溶液中存在()、—两种离子,它们间有如下转化关系:()(蓝色)——(黄色);电解不同浓度的溶液,均可看做、—直接放电。下图为电解浓度较大溶液的装置,实验开始后,观察到丙中的淀粉溶液慢慢变蓝。回答下列问题:()甲电极的电极反应式为。()丙中溶液变蓝是乙电极产物与反应导致的,该反应的化学方程式为。()随电解的不断进行,装置中溶液的颜色变化为;.由黄色变为浅蓝色.由蓝色变为浅黄色溶液颜色变化的原因是。()当电解到一定程度,甲电极附近出现蓝色()絮状物。经测,甲电极附近溶液的,此时甲电极附近()·(已知:()的×)。()电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将氧化为。该反应的离子方程式为。.(分)实验室可用和混合加热的方法制取氧气:.现有下列仪器或装置:3/5()—装置中,用作为原料制氧气的反应装置是(填序号)。()排水法收集氧气,接口顺序是:氧气出口→→→→→烧杯(填序号)。Ⅱ.分解时尚有副反应,导致收集到的气体有异味。据推测,副产物可能是、、中的一种或几种。资料表明:、、的沸点依次为-111℃、-34℃和11℃,且、也能将氧化为。为探究副反应气体产物的成分,将分解产生的气体经干燥后通入如右装置进行实验:()若要确认副产物中含,中应盛放溶液。()确定副产物中含有的现象是。()实验中若中无现象,中试纸变蓝,能否得出含有的结论?答:(填“能”或“不能”)。理由是。Ⅲ.是饮用水消毒剂。用处理过的饮用水(为~)除含有外,常含有一定量对人体不利的—。为测定此饮用水中两者成分,进行如下实验:准确量取水样加入到锥形...