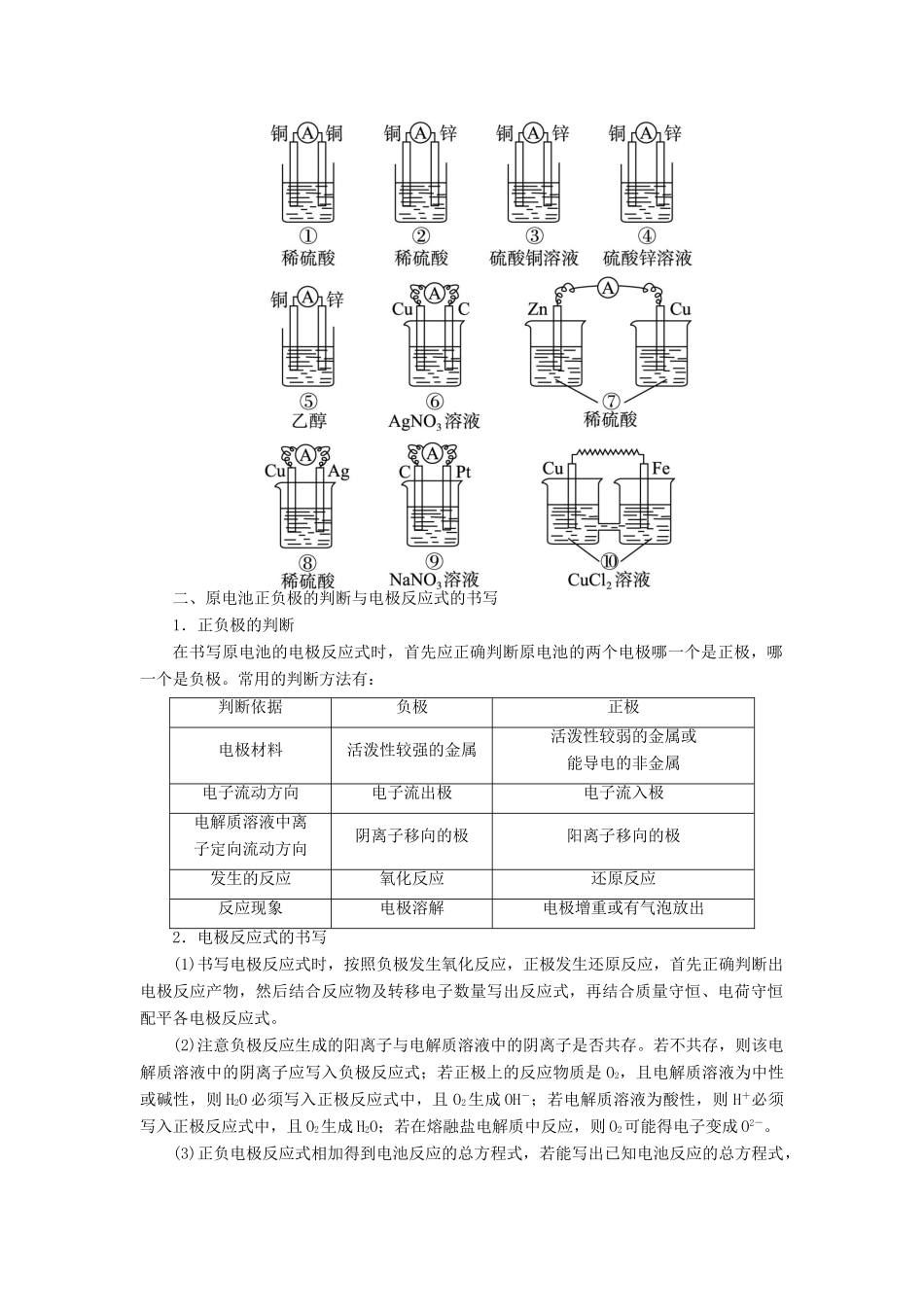
课题1原电池一、原电池工作原理1.原理图示2.原电池的判断方法(1)先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池,然后依据原电池的形成条件分析判断,主要是“四看”:看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极);看溶液——两极插入溶液中;看回路——形成闭合回路或两极直接接触;看本质——有无氧化还原反应发生。(2)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看作电解池。【例1】在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是()A.正极附近的SO浓度逐渐增大B.电子通过导线由铜片流向锌片C.正极有O2逸出D.铜片上有H2逸出解析:本题符合铜锌原电池的形成条件,原电池工作时,电子由负极(锌)经外电路(导线)流向正极(铜)。负极锌片:Zn-2e-===Zn2+;正极铜片:2H++2e-===H2↑;总反应为:Zn+2H+===Zn2++H2↑。原电池中没有产生O2。SO向负极移动。答案:D1-1下列装置中明显有电流产生的是()二、原电池正负极的判断与电极反应式的书写1.正负极的判断在书写原电池的电极反应式时,首先应正确判断原电池的两个电极哪一个是正极,哪一个是负极。常用的判断方法有:判断依据负极正极电极材料活泼性较强的金属活泼性较弱的金属或能导电的非金属电子流动方向电子流出极电子流入极电解质溶液中离子定向流动方向阴离子移向的极阳离子移向的极发生的反应氧化反应还原反应反应现象电极溶解电极增重或有气泡放出2.电极反应式的书写(1)书写电极反应式时,按照负极发生氧化反应,正极发生还原反应,首先正确判断出电极反应产物,然后结合反应物及转移电子数量写出反应式,再结合质量守恒、电荷守恒配平各电极反应式。(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则H2O必须写入正极反应式中,且O2生成OH-;若电解质溶液为酸性,则H+必须写入正极反应式中,且O2生成H2O;若在熔融盐电解质中反应,则O2可能得电子变成O2-。(3)正负电极反应式相加得到电池反应的总方程式,若能写出已知电池反应的总方程式,可以减去较易写出的电极反应式,从而得到较难写出的电极反应式。【例2】一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是()A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq)B.O2(g)+4H+(aq)+4e-===2H2O(l)C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)D.O2(g)+2H2O(l)+4e-===4OH-解析:原电池中负极发生氧化反应,应是燃料甲醇在负极上失电子,O2在正极上得电子发生还原反应,由于电解质是酸性溶液,负极产物是CO2,正极产物是H2O。答案:C2-1用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是()①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++e-===Ag③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同A.①②B.②③C.②④D.③④2-2可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是()A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变D.电池工作时,电子通过外电路从正极流向负极三、金属的腐蚀与防护1.化学腐蚀与电化学腐蚀的区别化学腐蚀电化学腐蚀含义金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程电子得失金属直接将电子转移给有氧化性的物质活泼金属将电子间接转移给氧化性较强的物质电流无电流产生有微弱电流产生腐蚀对象金属单质较活泼金属实例金属与Cl2、O2等物质直接反应钢铁在潮湿的空气中被腐蚀2...