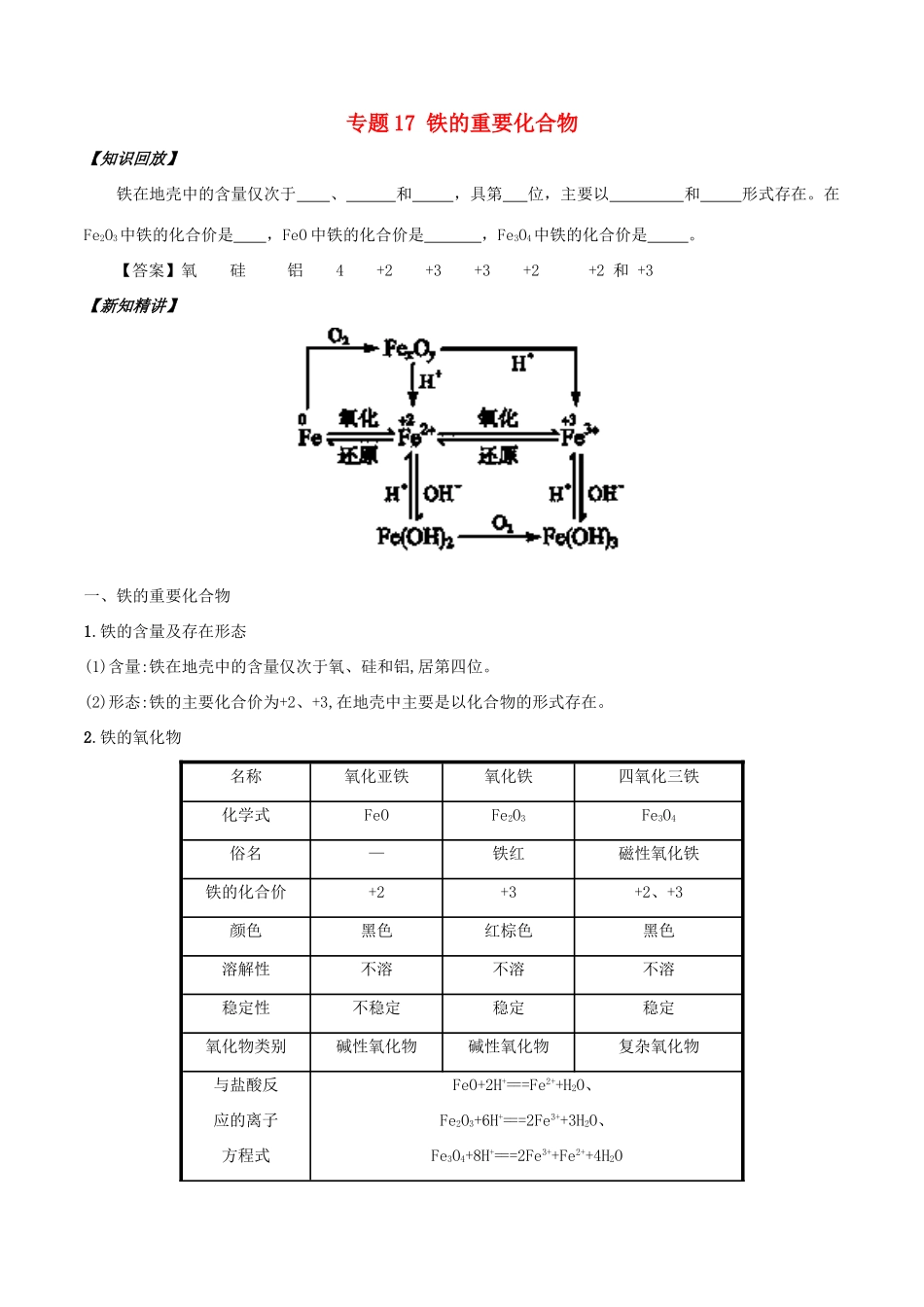
专题17铁的重要化合物【知识回放】铁在地壳中的含量仅次于、和,具第位,主要以和形式存在。在Fe2O3中铁的化合价是,FeO中铁的化合价是,Fe3O4中铁的化合价是。【答案】氧硅铝4+2+3+3+2+2和+3【新知精讲】一、铁的重要化合物1.铁的含量及存在形态(1)含量:铁在地壳中的含量仅次于氧、硅和铝,居第四位。(2)形态:铁的主要化合价为+2、+3,在地壳中主要是以化合物的形式存在。2.铁的氧化物名称氧化亚铁氧化铁四氧化三铁化学式FeOFe2O3Fe3O4俗名—铁红磁性氧化铁铁的化合价+2+3+2、+3颜色黑色红棕色黑色溶解性不溶不溶不溶稳定性不稳定稳定稳定氧化物类别碱性氧化物碱性氧化物复杂氧化物与盐酸反应的离子方程式FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O、Fe3O4+8H+===2Fe3++Fe2++4H2O用途氧化铁:红色油漆、涂料、炼铁原料3.铁的氢氧化物Fe(OH)2Fe(OH)3颜色白色红褐色溶解性不溶不溶稳定性在空气中易转化为Fe(OH)32Fe(OH)3CombinFe2O3+3H2O与盐酸反应(离子方程式)Fe(OH)2+2H+===Fe2++2H2OFe(OH)3+3H+===Fe3++3H2O制备(离子方程式)Fe2++2OH-===Fe(OH)2↓Fe3++3OH-===Fe(OH)3↓转化化学方程式4Fe(OH)2+O2+2H2O===4Fe(OH)3现象白色沉淀迅速变成灰绿色,最后变成红褐色4.铁盐、亚铁盐(1)Fe3+的检验:(2)Fe2+和Fe3+的转化:Fe2+Fe3+写出下列反应的离子方程式:①FeCl3溶液与铁粉:2Fe3++Fe===3Fe2+;②FeCl2溶液与氯水:2Fe2++Cl2===2Fe3++2Cl-。(3)铁盐的净水作用:铁盐在天然水中可生成Fe(OH)3胶体,和水中的悬浮物形成絮状不溶物沉降下来。二、铜盐1.铜属于重金属,化学性质不活泼,使用铜器皿比较安全。2.硫酸铜、氯化铜、硝酸铜等铜盐易溶于水,都有毒。3.铜绿的主要成分是Cu2(OH)2CO3,其难溶于水。【科学探究】探究一“铁三角”的转化关系分析问题导引1.FeCl3溶液中逐渐加入锌粉的反应情况如何?提示FeCl3溶液逐渐加入锌粉,开始FeCl3溶液过量,首先发生2Fe3++Zn===2Fe2++Zn2+,当锌粉过量后发生Fe2++Zn===Fe+Zn2+。2.金属阳离子被还原一定得到金属单质吗?提示不一定。Fe3+被还原可以生成Fe,也可以被还原生成Fe2+。探究二Fe3+和Fe2+的检验、提纯问题导引1.若先加少量氯水,再加KSCN溶液,溶液变为红色,能否证明溶液中含有Fe2+?提示不能,因为若原溶液中含有Fe3+,也会有同样的现象,不能确定原溶液中一定含有Fe2+。2.若Fe2(SO4)3溶液中可能含有Fe2+,用何种方法检验Fe2+是否存在?提示选用酸性KMnO4溶液,Fe2+可使紫色的酸性KMnO4溶液褪色。【重点突破】1.Fe、Fe2+、Fe3+性质(1)Fe只有还原性,可以被氧化成+2价或+3价的铁如Fe+2H+===H2↑+Fe2+2Fe+3Cl2Combin2FeCl33Fe+4H2O(g)CombinFe3O4+4H2(2)Fe2+既有氧化性又有还原性如2Fe2++Cl2===2Fe3++2Cl-Zn+Fe2+===Fe+Zn2+(3)Fe3+具有较强的氧化性,可被还原为+2价或0价的铁如2Fe3++Cu===2Fe2++Cu2+3CO+Fe2O3Combin2Fe+3CO22.Fe3+、Fe2+检验(1)Fe3+、Fe2+的检验方法Fe2+Fe3+观察法浅绿色棕黄色加碱(NaOH)法①现象:白色沉淀灰绿色红褐色沉淀②反应:Fe2++2OH-===Fe(OH)2↓(白色)4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)①现象:红褐色沉淀②应:Fe3++3OH-===Fe(OH)3↓(红褐色)加盐(SCN-)法①现象:加入KSCN溶液无明显现象,再滴入氯水变成红色溶液②反应:2Fe2++Cl2===2Fe3++2Cl-Fe3++3SCN-===Fe(SCN)3(红色)①现象:加入KSCN溶液,溶液变为红色②反应:Fe3++3SCN-===Fe(SCN)3(红色)(2)Fe3+与Fe2+检验时的注意事项①根据Fe3+、Fe2+的颜色利用观察法检验Fe3+、Fe2+时,适用于浓度较大时,若溶液较稀,离子浓度较小,易产生干扰,一般不用此法检验。②利用KSCN检验Fe2+时,要注意加入试剂的顺序,即先加入KSCN溶液,再加入氯水,以免发生误检。③Fe3+与SCN-作用后的“溶液”显红色,注意并不是“沉淀”。【典题探究】典例1已知有以下物质相互转化试回答:(1)B的化学式:、D的化学式:。(2)写出由E转变成F的化学方程式:。(3)常用检验G中的阳离子,其现象为。(4)向G溶液加入A的有关反应的离子方程式为。【答案】:(1)FeCl2KCl(2)4Fe(OH)2+2H2O+O2===4Fe(OH)3(3)KSCN溶液棕黄色溶液变为红色溶液(4)2Fe3++Fe===3Fe2+变式训练1-1按下图要求写出下列三个反应的化学方程式,属于离子反应的只写出离子...