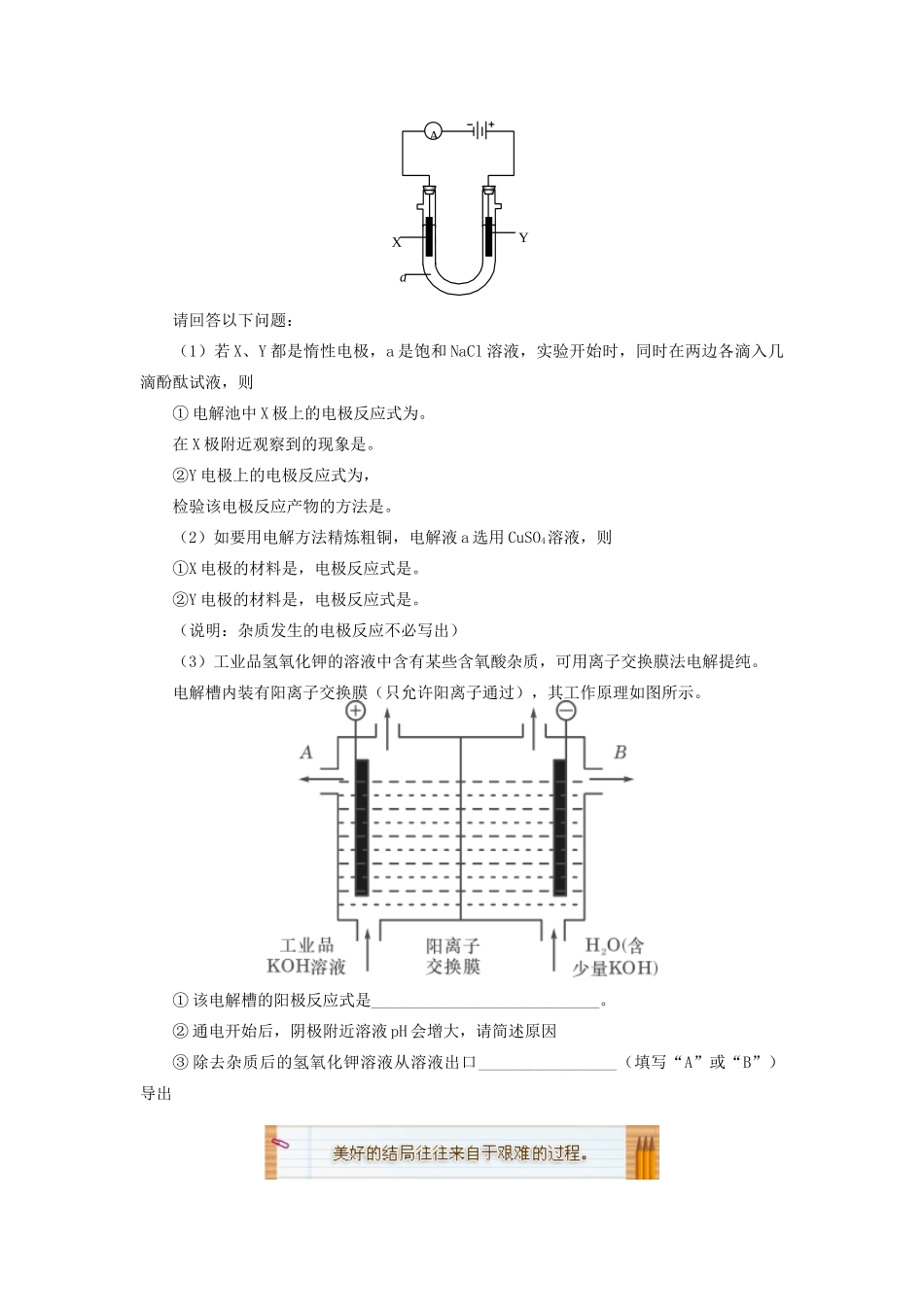
第二单元化学能与电能的转化4电解原理的应用(答题时间:20分钟)一、选择题1.在冶金工业上,常用电解法得到Na、Mg、Al等金属,其原因主要是()A.这些金属的化合物熔点低B.它们都是轻金属C.它们的性质很活泼D.此方法成本低2.下列可被工业上采用的冶金方法是()A.电解熔融的氯化铝制铝B.电解熔融的氯化镁制镁C.电解氯化钠溶液制钠D.高温下用H2还原氧化镁制镁3.下列有关电解精炼铜的说法中错误的是()A.粗铜做阴极B.电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子C.阳极泥中含有金、银等贵重金属D.电解质溶液可以选用硫酸铜溶液4.电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是()A.电解时以硫酸铜溶液作电解液,精铜作阳极B.粗铜与电源负极相连,发生氧化反应C.阴极上发生的反应是Cu2++2e-=CuD.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥5.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是()A.铅笔端作阳极,发生还原反应B.铂片端作阴极,发生氧化反应C.铅笔端有少量的氯气产生D.a点是负极,b点是正极6.如图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是()A.电源a极为负极B.Ⅰ极上铜放电而逐渐消耗C.Ⅱ极上发生的电极反应为Fe-2e-=Fe2+D.Ⅱ极上Cu2+放电而使溶液中Cu2+浓度逐渐变小7.关于惰性电极电解NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性二、填空题8.(1)用惰性电极电解饱和NaCl溶液,请写出:①阳极的电极反应为:;总反应离子方程式:。②要使电解后的溶液恢复到和原溶液一样,则应加入一定量的。(2)用电解法精炼粗铜,电解液选用CuSO4溶液。请回答:①阳极的电极材料是,电极反应式是;②阴极电极的材料是,电极反应式是。(杂质发生的电极反应不必写出)9.粗铜中常含有锌、镍、银、金等杂质,工业上常用电解的方法精炼粗铜。(1)电解时__________作阳极,电极反应式为________________;_____________作阴极,电极反应式为_________________________。(2)电解前CuSO4溶液的浓度为1mol·L-1,电解时如有0.5mol电子发生转移,则此时电解液中CuSO4的浓度为_______________,阴极得到的纯铜质量为_______________。阳极泥的主要成分是______________。10.电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。AaXY请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为。在X极附近观察到的现象是。②Y电极上的电极反应式为,检验该电极反应产物的方法是。(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是,电极反应式是。②Y电极的材料是,电极反应式是。(说明:杂质发生的电极反应不必写出)(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。①该电解槽的阳极反应式是____________________________。②通电开始后,阴极附近溶液pH会增大,请简述原因③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出一、选择题1.C解析:某些活泼金属或某些活泼非金属因从化合物中还原或氧化制取很难,故采用电解法。例如:2NaCl=====2Na+Cl2↑MgCl2=====Mg+Cl2↑2Al2O3=====4Al+3O2↑2NaCl+2H2O=====2NaOH+H2↑+Cl2↑2KHF2=====2KF+H2↑+F2↑2.B解析:氯化铝是共价化合物,熔融状态下以分子状态存在,其中缺少自由移动的离子,故不能用电解熔融氯化铝的方法制铝。A不正确。Na+、Mg2+、Al3+在水溶液中电解时,电子被H+得到,因而电解比氢活泼的金属阳离子的水溶液是得不到金属单质的。C不...