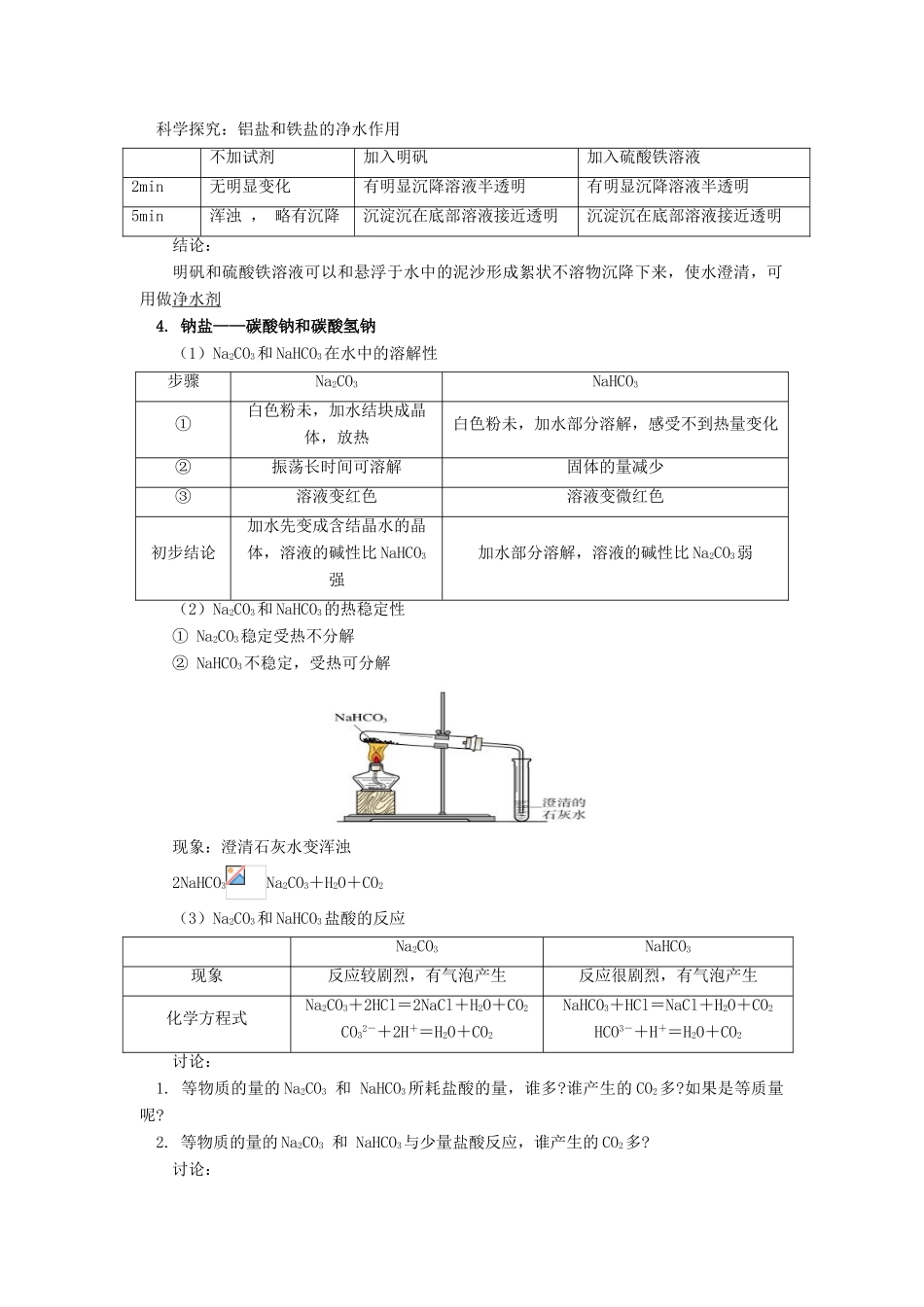
高一化学金属化合物(二)苏教版【本讲教育信息】一.教学内容:金属化合物(二)二.教学目标1.知识与技能目标(1)了解Fe3+的检验方法,理解Fe3+的氧化性,Fe3+与Fe2+的相互转化,巩固、提高氧化还原反应知识;(2)通过实验探究,比较碳酸钠和碳酸氢钠的性质,掌握鉴别它们的方法;(3)了解焰色反应及其运用。2.过程与方法目标(1)通过分类、比较的方法学习碳酸钠和碳酸氢钠的性质,使学生学会分类、比较科学的研究方法;(2)通过实验探究,让学生学会理论知识应用于实践,学会用已学知识分析解决新问题。3.情感态度与价值观目标通过多种活动,让学生体验成功的喜悦,同时培养学生善于与他人合作的良好心理品质.三.教学重点、难点1.Fe3+的氧化性,Fe3+与Fe2+的相互转化2.碳酸钠与碳酸氢钠的性质四.教学方法讨论+探究+实验五.教学过程(接第一课时)3.铁盐(FeCl3FeCl2)怎样鉴别FeCl2与FeCl3溶液?(1)看颜色(2)利用化学性质:A.滴加NaOHB.滴加KSCNFe3+离子的检验向FeCl3和FeCl2溶液中分别加入KSCN溶液滴入KSCN溶液FeCl3溶液溶液呈血红色FeCl2溶液溶液颜色无变化Fe3+与Fe3+离子的性质(1)Fe2+的性质(弱氧化性+弱还原性)(2)Fe3+的性质(氧化性)Fe3+离子的氧化性实验1:在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液现象:溶液不显血红色结论:溶液中已不含Fe3+反应方程式:2FeCl3+Fe=3FeCl2(氧化剂)(还原剂)实验2:在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2)现象:溶液变成血红色结论:原溶液中的Fe2+转变成Fe3+反应方程式:2FeCl2+Cl2=2FeCl3(还原剂)(氧化剂)总结:Fe2+与Fe3+离子的相互转化:科学探究:铝盐和铁盐的净水作用不加试剂加入明矾加入硫酸铁溶液2min无明显变化有明显沉降溶液半透明有明显沉降溶液半透明5min浑浊,略有沉降沉淀沉在底部溶液接近透明沉淀沉在底部溶液接近透明结论:明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂4.钠盐——碳酸钠和碳酸氢钠(1)Na2CO3和NaHCO3在水中的溶解性步骤Na2CO3NaHCO3①白色粉未,加水结块成晶体,放热白色粉未,加水部分溶解,感受不到热量变化②振荡长时间可溶解固体的量减少③溶液变红色溶液变微红色初步结论加水先变成含结晶水的晶体,溶液的碱性比NaHCO3强加水部分溶解,溶液的碱性比Na2CO3弱(2)Na2CO3和NaHCO3的热稳定性①Na2CO3稳定受热不分解②NaHCO3不稳定,受热可分解现象:澄清石灰水变浑浊2NaHCO3Na2CO3+H2O+CO2(3)Na2CO3和NaHCO3盐酸的反应Na2CO3NaHCO3现象反应较剧烈,有气泡产生反应很剧烈,有气泡产生化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2CO32-+2H+=H2O+CO2NaHCO3+HCl=NaCl+H2O+CO2HCO3-+H+=H2O+CO2讨论:1.等物质的量的Na2CO3和NaHCO3所耗盐酸的量,谁多?谁产生的CO2多?如果是等质量呢?2.等物质的量的Na2CO3和NaHCO3与少量盐酸反应,谁产生的CO2多?讨论:1.向Na2CO3溶液中缓慢加入盐酸2.向盐酸溶液中缓慢加入Na2CO3分析其现象的异同总结:Na2CO3NaHCO3俗名纯碱苏打小苏打水溶性易溶可溶溶液碱性较强较弱与酸作用反应较剧烈Na2CO3+2HCl=2NaCl+H2O+CO2反应很剧烈NaHCO3+HCl=NaCl+H2O+CO2热稳定性稳定加热难分解不稳定,加热可分解2NaHCO3Na2CO3+H2O+CO25.焰色反应①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈黄色②钠燃烧时,火焰呈黄色很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应实验教材(P53:实验3—9)用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。问题:1.铂丝为什么要用盐酸洗涤?2.为什么要用蓝色钴玻璃观察钾的焰色?一些金属及化合物的焰色反应紫红色黄色紫色砖红色洋红色黄绿色绿色焰色反应的运用:(一)判断物质成分各种物质的焰色反应,都有其特殊的焰色,因此,根据焰色反应,可以判断物质所含元素(金属)(二)制作焰火节日燃放的五彩缤纷的烟花,就是碱金属以及锶、钡等金属化合物所呈现的各种艳丽的色彩。【模拟试题】一、单项选择题:1.下列物质露置在空气中,质量会减轻的是()A.NaOHB...