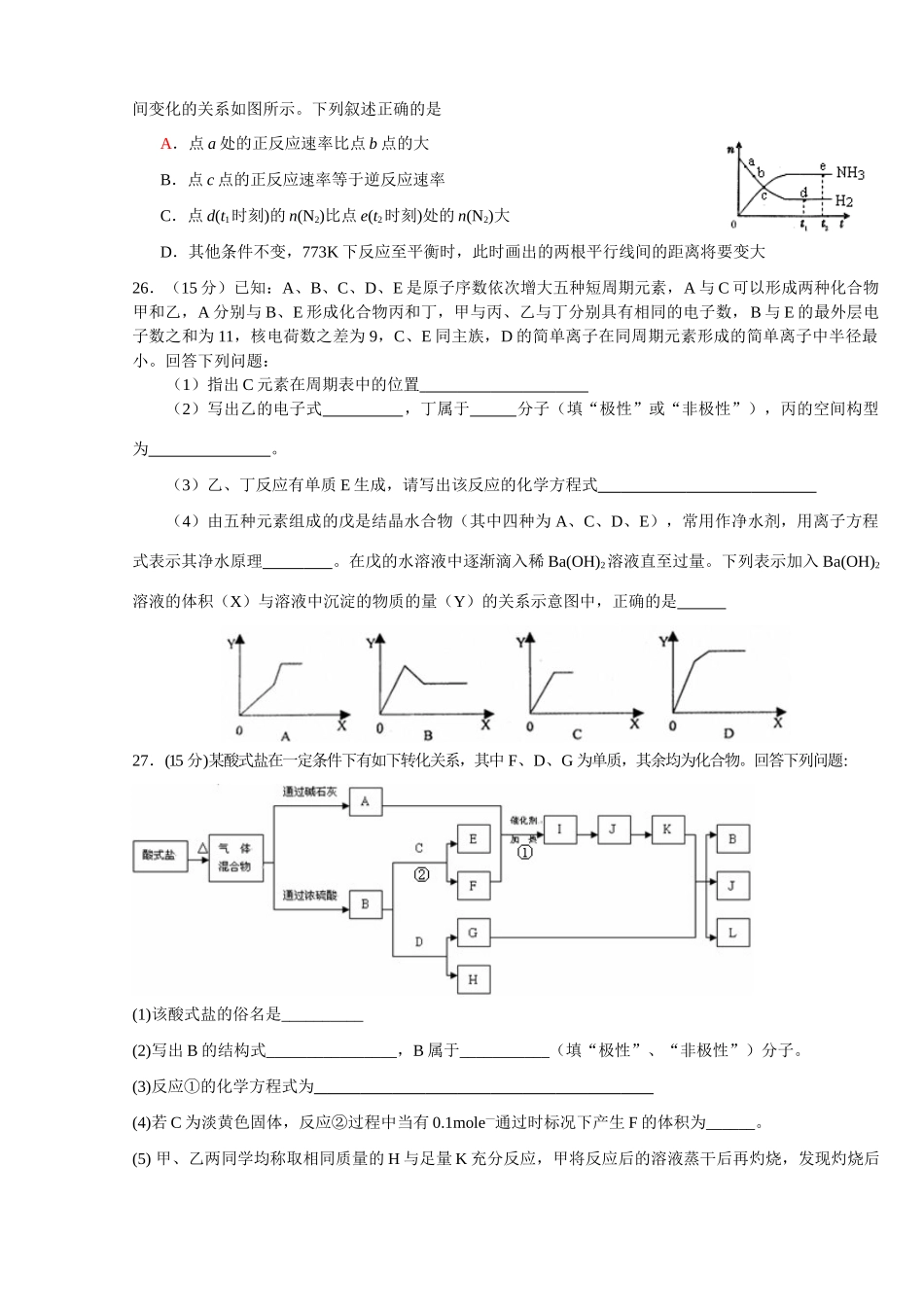
化学信息题1.下列说法正确的是A.冰灾时大量使用的融雪剂——“工业食盐”,即廉价、又绿色环保B.奥运火炬燃料的选择主要考虑的是成本,与环保等其它因素无关C.为了防止水污染,我国许多旅游区规定销售使用的洗衣粉中尽量少含或不含磷元素D.即使全球粮食紧张,也要大力提倡使用酿造酒精代替化石燃料以减缓“温室效应”2.用NA表示阿伏加德罗常数,下列说法错误的是A.1molCH5+离子中含有电子数为10NAB.在常压、室温条件下,48g氧气和臭氧的混合气体所含的原子数为3NAC.0.1molFe与0.1molCl2充分反应,转移的电子数为0.2NAD.11.2L的NH3中含有的原子总数为2NA3.pH=0的某无色溶液中一定能大量共存的离子组是A.K+、Ca2+、NO3-、Cl-B.NO3-、K+、Ba2+、Fe2+C.NH4+、Na+、Cu2+、SO42-D.Na+、Ca2+、SO42-、Cl-4.下列说法中不正确的是A.向碘水中加入适量的CCl4,充分振荡,静置分层,下层颜色比上层深B.将Na2O2加入到少量FeCl2溶液中充分振荡,立即产生红褐色沉淀和无色气体C.马口铁(镀锡铁)的镀层破损后,铁很快被腐蚀D.用稀硫酸和稀硝酸分别溶解铁片时,都会有黄色溶液出现5.用惰性电极电解下列电解质溶液,有关叙述正确的是A.电解饱和NaCl溶液一小会儿后,要恢复到电解前状态,应加人适量的盐酸B.电解CuSO4溶液,阳极反应式:2H2O+O2+4e一=4OH一C.Na2SO4溶液在电解过程中,阴极区pH升高D.电解足量CuCl2溶液时,当阳极上产生2.24L气体时(标准状况)阴极增重12.8g6.下列说法不正确的是A.用王水配成的稀溶液中:c(H+)=c(Cl-)+c(NO3-)+c(OH-)B.0.lmol/L的碳酸钠溶液中:c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)C.25℃,pH=7的(NH4)2SO4和NH3·H2O混合液中:c(NH4+)=2c(SO42-)D.25℃时,将100mLb1mol/L的CH3COOH溶液加人到100mLb2mol/L的NaOH溶液中,如果混合溶液的pH=7,则b1>b27.乙酸在一定条件下能生成一种重要的有机试剂M。核磁共振光谱发现M分子中的氢原子没有差别,红外光谱发现M分子里存在羰基,且M分子中所有原子在一个平面上。M极易与水反应重新变为乙酸,则M分子的结构简式可能是A.(CH3CO)2OB.CH2=COC.CH3CHOD.HCHO8.对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g);△H<0,在672K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是A.点a处的正反应速率比点b点的大B.点c点的正反应速率等于逆反应速率C.点d(t1时刻)的n(N2)比点e(t2时刻)处的n(N2)大D.其他条件不变,773K下反应至平衡时,此时画出的两根平行线间的距离将要变大26.(15分)已知:A、B、C、D、E是原子序数依次增大五种短周期元素,A与C可以形成两种化合物甲和乙,A分别与B、E形成化合物丙和丁,甲与丙、乙与丁分别具有相同的电子数,B与E的最外层电子数之和为11,核电荷数之差为9,C、E同主族,D的简单离子在同周期元素形成的简单离子中半径最小。回答下列问题:(1)指出C元素在周期表中的位置(2)写出乙的电子式,丁属于分子(填“极性”或“非极性”),丙的空间构型为。(3)乙、丁反应有单质E生成,请写出该反应的化学方程式(4)由五种元素组成的戊是结晶水合物(其中四种为A、C、D、E),常用作净水剂,用离子方程式表示其净水原理。在戊的水溶液中逐渐滴入稀Ba(OH)2溶液直至过量。下列表示加入Ba(OH)2溶液的体积(X)与溶液中沉淀的物质的量(Y)的关系示意图中,正确的是27.(15分)某酸式盐在一定条件下有如下转化关系,其中F、D、G为单质,其余均为化合物。回答下列问题:(1)该酸式盐的俗名是__________(2)写出B的结构式________________,B属于___________(填“极性”、“非极性”)分子。(3)反应①的化学方程式为(4)若C为淡黄色固体,反应②过程中当有0.1mole—通过时标况下产生F的体积为______。(5)甲、乙两同学均称取相同质量的H与足量K充分反应,甲将反应后的溶液蒸干后再灼烧,发现灼烧后的固体质量与反应前所称的H的质量相同,原因是乙将反应后的溶液在K蒸气中低温蒸干后得到一种结晶水合物X,X中含水的质量分数为42.2%,将X再加热使其完全分解,有红棕色气体产生并剩余一种白色固体,称量发现反应后的白色固体质量也...