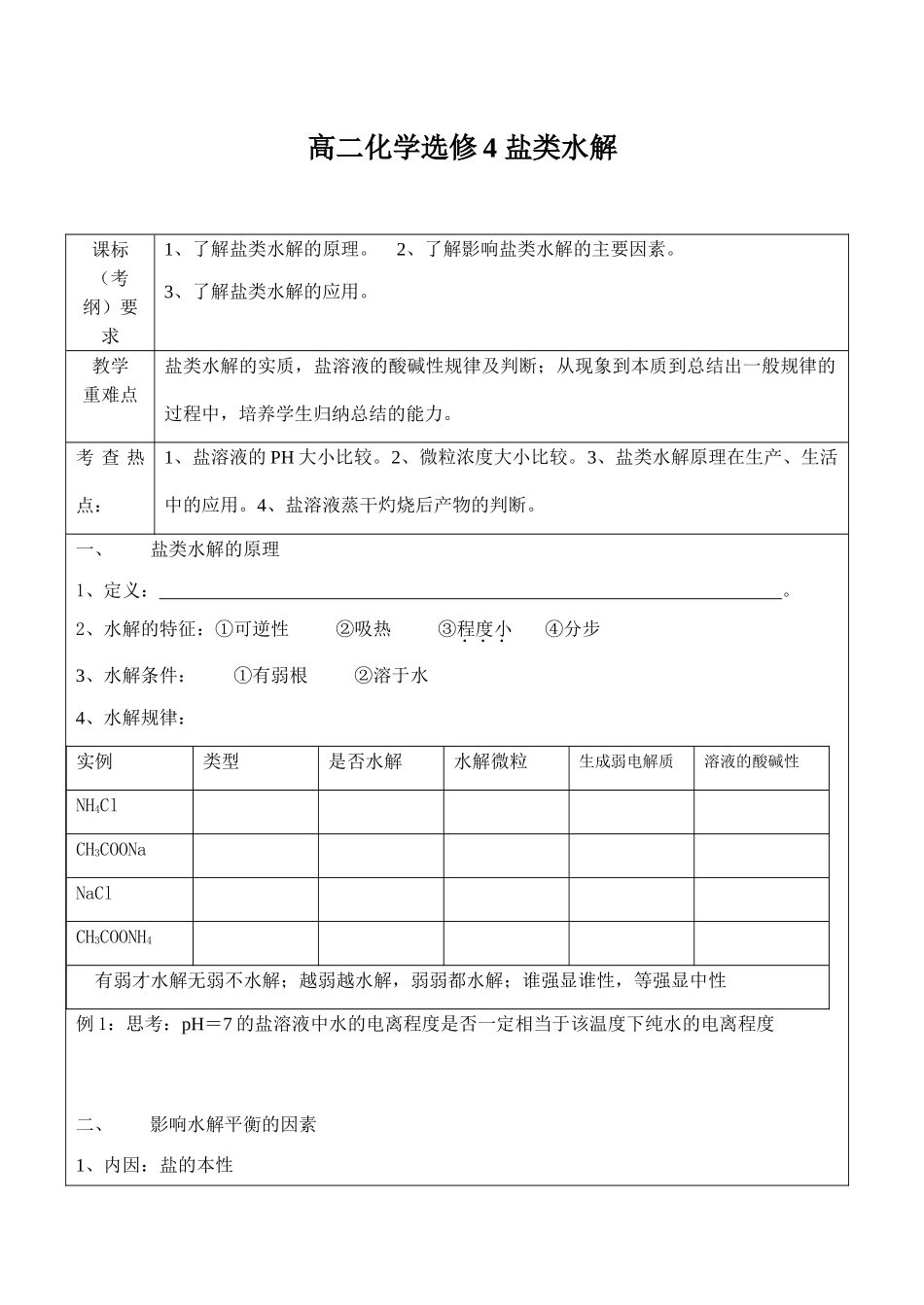
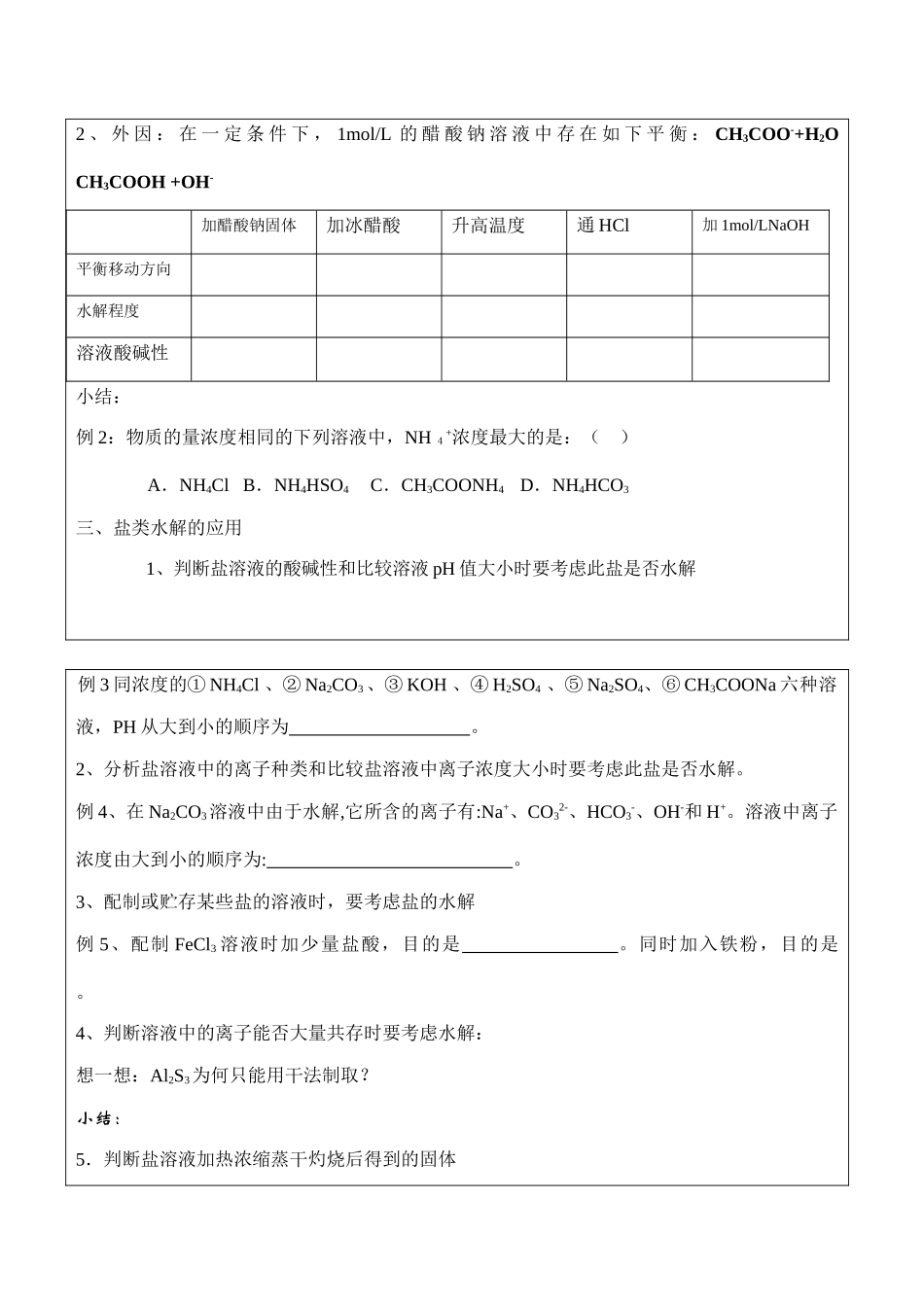
高二化学选修4盐类水解课标(考纲)要求1、了解盐类水解的原理。2、了解影响盐类水解的主要因素。3、了解盐类水解的应用。教学重难点盐类水解的实质,盐溶液的酸碱性规律及判断;从现象到本质到总结出一般规律的过程中,培养学生归纳总结的能力。考查热点:1、盐溶液的PH大小比较。2、微粒浓度大小比较。3、盐类水解原理在生产、生活中的应用。4、盐溶液蒸干灼烧后产物的判断。一、盐类水解的原理1、定义:。2、水解的特征:①可逆性②吸热③程度小④分步3、水解条件:①有弱根②溶于水4、水解规律:实例类型是否水解水解微粒生成弱电解质溶液的酸碱性NH4ClCH3COONaNaClCH3COONH4有弱才水解无弱不水解;越弱越水解,弱弱都水解;谁强显谁性,等强显中性例1:思考:pH=7的盐溶液中水的电离程度是否一定相当于该温度下纯水的电离程度二、影响水解平衡的因素1、内因:盐的本性2、外因:在一定条件下,1mol/L的醋酸钠溶液中存在如下平衡:CH3COO-+H2OCH3COOH+OH-加醋酸钠固体加冰醋酸升高温度通HCl加1mol/LNaOH平衡移动方向水解程度溶液酸碱性小结:例2:物质的量浓度相同的下列溶液中,NH4+浓度最大的是:()A.NH4ClB.NH4HSO4C.CH3COONH4D.NH4HCO3三、盐类水解的应用1、判断盐溶液的酸碱性和比较溶液pH值大小时要考虑此盐是否水解例3同浓度的①NH4Cl、②Na2CO3、③KOH、④H2SO4、⑤Na2SO4、⑥CH3COONa六种溶液,PH从大到小的顺序为。2、分析盐溶液中的离子种类和比较盐溶液中离子浓度大小时要考虑此盐是否水解。例4、在Na2CO3溶液中由于水解,它所含的离子有:Na+、CO32-、HCO3-、OH-和H+。溶液中离子浓度由大到小的顺序为:。3、配制或贮存某些盐的溶液时,要考虑盐的水解例5、配制FeCl3溶液时加少量盐酸,目的是。同时加入铁粉,目的是。4、判断溶液中的离子能否大量共存时要考虑水解:想一想:Al2S3为何只能用干法制取?小结:5.判断盐溶液加热浓缩蒸干灼烧后得到的固体例6.AlCl3、Al2(SO4)3的溶液分别蒸干灼烧所得固体分别为。6、生活生产中的应用四、溶液中各种微粒浓度之间的关系——三种守恒关系例7.写出0.1mol/LNa2CO3溶液中微粒向后三种守恒关系式。①电荷守恒:。②物料守恒:。③质子守恒:。当堂测试)1、下列关于盐类水解的叙述正确的是:A.溶液呈中性的盐一定是强酸与强碱生成的盐B.含有弱酸根盐的水溶液一定显碱性C.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱D.Na2SO4水溶液呈中性是因为NaOH和H2SO4的电离度相同()2、将10mL0.1mol/L的氨水与5mL0.2mol/L盐酸混和后溶液中离子浓度关系正确的是A.[Cl-]>[NH4+]>[OH+]>[H+]B.[Cl-]>[NH4+]>[H+]>[OH-]C.[NH4+]>[Cl-]>[H+]>[OH-]D.[H+]>[Cl-]>[NH4+]>[OH-]()3、CH3COOH与CH3COONa等物质的量混合配制成稀溶液,pH值为4.7,下列说法错误的是A.CH3COOH的电离作用大于CH3COONa的水解作用B.CH3COOH的存在抑制了CH3COONa的水解C.CH3COONa的存在抑制了CH3COOH的电离D.CH3COONa的水解作用大于CH3COOH的电离作用