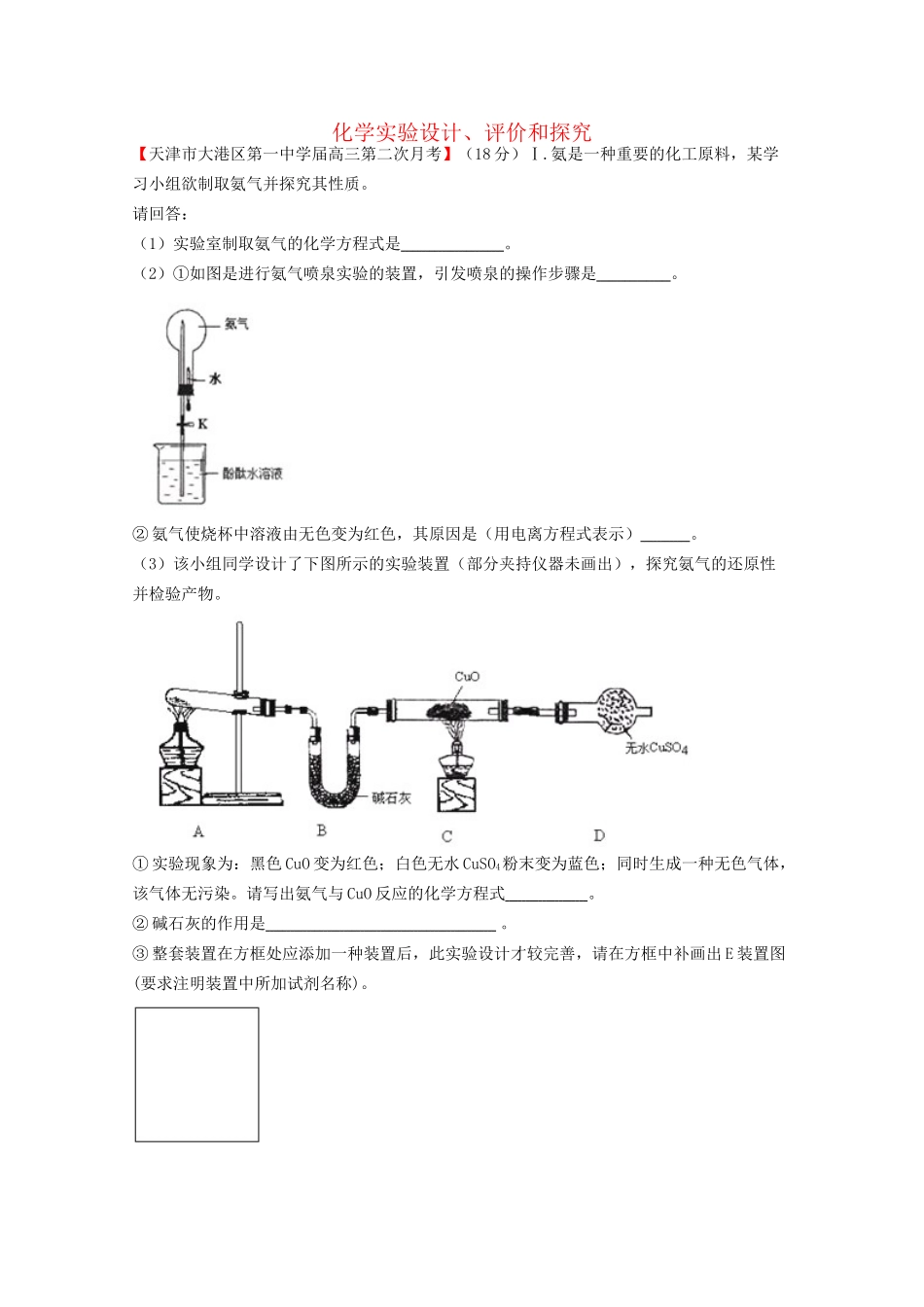
化学实验设计、评价和探究【天津市大港区第一中学届高三第二次月考】(18分)Ⅰ.氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:(1)实验室制取氨气的化学方程式是。(2)①如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是。②氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)。(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式。②碱石灰的作用是。③整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。Ⅱ.3.2gCu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为amol,则:①此时溶液中所含的NO3-为mol。②所生成的NO在标准状况下体积为L。(以上结果均用含a的代数式表示)Ⅲ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:(1)③中在煅烧过程中一定发生的反应的化学方程式为。(2)关于固体甲的成分的判断中,下列说法正确的是A.固体甲中,CuS和Cu2S不能同时存在;B.固体甲中,CuO和Cu2O至少有一种;C.固体甲中若没有Cu2O,则一定有Cu2S;D.固体甲中若存在Cu2O,也可能有Cu2S。【答案】Ⅰ.(1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O(2)①轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K。②NH3+H2ONH3·H2ONH4++OH-(3)①3CuO+2NH33Cu+N2+3H2O②吸收氨气中有的水蒸气,防止干扰产物水的测定。③如图所示:(合理即给分)。最好是下层CCl4上层H2O,导管通到CCl4中Ⅱ.①(a+0.1)mol②11.2(a-0.04)LⅢ(1)CuS+3O22SO2+2CuO(条件:高温或煅烧都可)(2)BCD【浙江省宁波市效实中学届高三上学期期中考试】(12分)信息时代产生的大量电子垃圾对“”环境构成了极大的威胁。某变废为宝学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:请回答下列问题:⑴第①步Cu与混酸反应的离子方程式为______________________________;得到滤渣1的主要成分为___________________。⑵第②步加H2O2的作用是_____________________,使用H2O2的优点是_________;调溶液pH的目的是使_______________________________生成沉淀。⑶简述第③步由滤液2得到CuSO4·5H2O的方法是________________________。⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:上述三种方案中,_________________方案不可行,原因是_________________________:从原子利用率角度考虑,___________方案更合理。⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+写出计算CuSO4·5H2O质量分数的表达式ω=_____________________________;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。a.未干燥锥形瓶b.滴定终点时滴定管尖嘴中产生气泡c.未除净可与EDTA反应的干扰离子【答案】⑴Cu+4H++2NOCu2++2NO2↑+2H2O或3Cu+8H++2NO3Cu2++2NO↑+4H2OAu、Pt⑵将Fe2+氧化为Fe3+不引入杂质,对环境无污染Fe3+、Al3+⑶蒸发冷却结晶过滤⑷甲所得产品中含有较多Fe2(SO4)3杂质乙⑸×100%c【江苏省灌南高级中学届高三上学期期中考试】(14分)FeSO4•7H2O广泛用于医药和工业领域。以下是FeSO4•7H2O的实验室制备流程图。根据题意完成下列填空:(1)碳酸钠溶液能除去酯类油污,是因为(用离子...