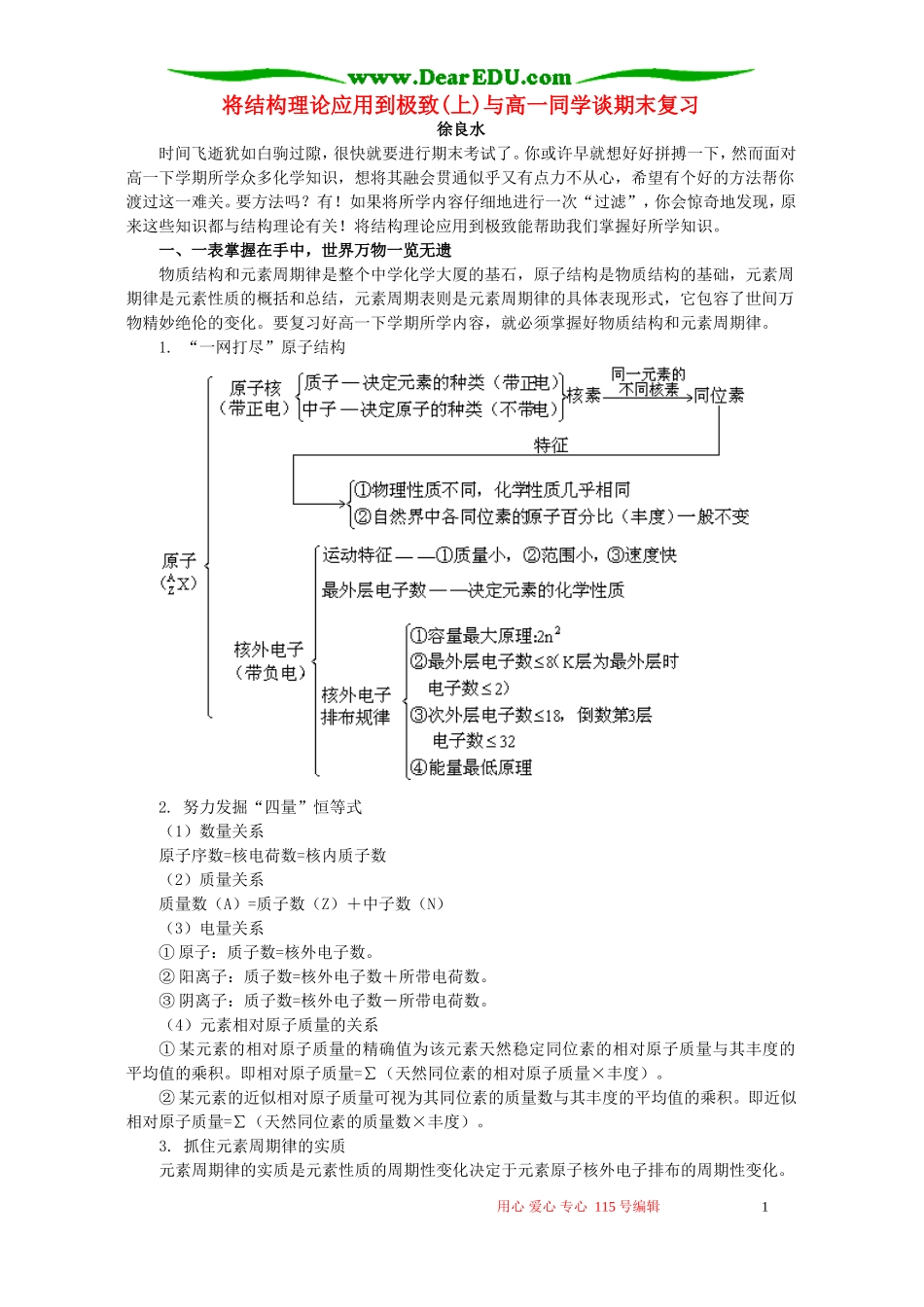
将结构理论应用到极致(上)与高一同学谈期末复习徐良水时间飞逝犹如白驹过隙,很快就要进行期末考试了。你或许早就想好好拼搏一下,然而面对高一下学期所学众多化学知识,想将其融会贯通似乎又有点力不从心,希望有个好的方法帮你渡过这一难关。要方法吗?有!如果将所学内容仔细地进行一次“过滤”,你会惊奇地发现,原来这些知识都与结构理论有关!将结构理论应用到极致能帮助我们掌握好所学知识。一、一表掌握在手中,世界万物一览无遗物质结构和元素周期律是整个中学化学大厦的基石,原子结构是物质结构的基础,元素周期律是元素性质的概括和总结,元素周期表则是元素周期律的具体表现形式,它包容了世间万物精妙绝伦的变化。要复习好高一下学期所学内容,就必须掌握好物质结构和元素周期律。1.“一网打尽”原子结构2.努力发掘“四量”恒等式(1)数量关系原子序数=核电荷数=核内质子数(2)质量关系质量数(A)=质子数(Z)+中子数(N)(3)电量关系①原子:质子数=核外电子数。②阳离子:质子数=核外电子数+所带电荷数。③阴离子:质子数=核外电子数-所带电荷数。(4)元素相对原子质量的关系①某元素的相对原子质量的精确值为该元素天然稳定同位素的相对原子质量与其丰度的平均值的乘积。即相对原子质量=∑(天然同位素的相对原子质量×丰度)。②某元素的近似相对原子质量可视为其同位素的质量数与其丰度的平均值的乘积。即近似相对原子质量=∑(天然同位素的质量数×丰度)。3.抓住元素周期律的实质元素周期律的实质是元素性质的周期性变化决定于元素原子核外电子排布的周期性变化。用心爱心专心115号编辑1元素周期律、原子核外电子排布、元素性质三者之间的关系:元素周期律元素性质的周期性变化原子核外电子排布的周期性变化。4.研究两个非常有用的表和图(1)一张包容世间万物的元素周期表目前我们所用的元素周期的是结构为18个纵行,7个横行,形如“凹”字。具体可用如下方法记忆:三短三长一不全,镧系锕系列下边;七主七副八与0,镧系锕系挤当中;左二右五中过渡,牢记周期原子数。(2)一幅体现“位、构、性”的关系图有了这些图表,后续课程的复习将一览无遗!二、结构理论到极致,氧、氮、碳族仅一线若能将结构理论应用到极致,则氧族、氮族和碳族元素它们内部“成员”之间以及与“外部”其他元素之间的关系,将变成简单的一条“线”。1.一线串尽硫、氮、碳运用物质结构理论对氧族、氮族和碳族元素进行考察,你将会发现硫、氮、碳元素仅是一线串,如:H2S→S→(SO2、H2SO3、Na2SO3)→(SO3、H2SO4、Na2SO4)根据每种价态元素的代表物,弄清每一步转化的条件和化学方程式,总结出每一族代表物质的结构、性质、制法、检验、用途、存在和相互转化关系。2.纵横比较法纵览硫、氮、碳在物质结构和元素周期律的基础上,采用下面两种方法进行对比学习,效果比较显著。(1)纵向比较——同族元素间的比较纵向比较也叫结构比较,如学习氧族元素时,首先比较氧、硫、硒、碲的原子结构,它们最外层都是6个电子,决定了它们具有相似的化学性质。又从O→Te,核电荷数增加,电子层数递增,原子半径逐渐增大,决定了它们的性质具有差异性。(2)横向比较——不同族元素间的比较(请同学们自行总结比较)用心爱心专心115号编辑2