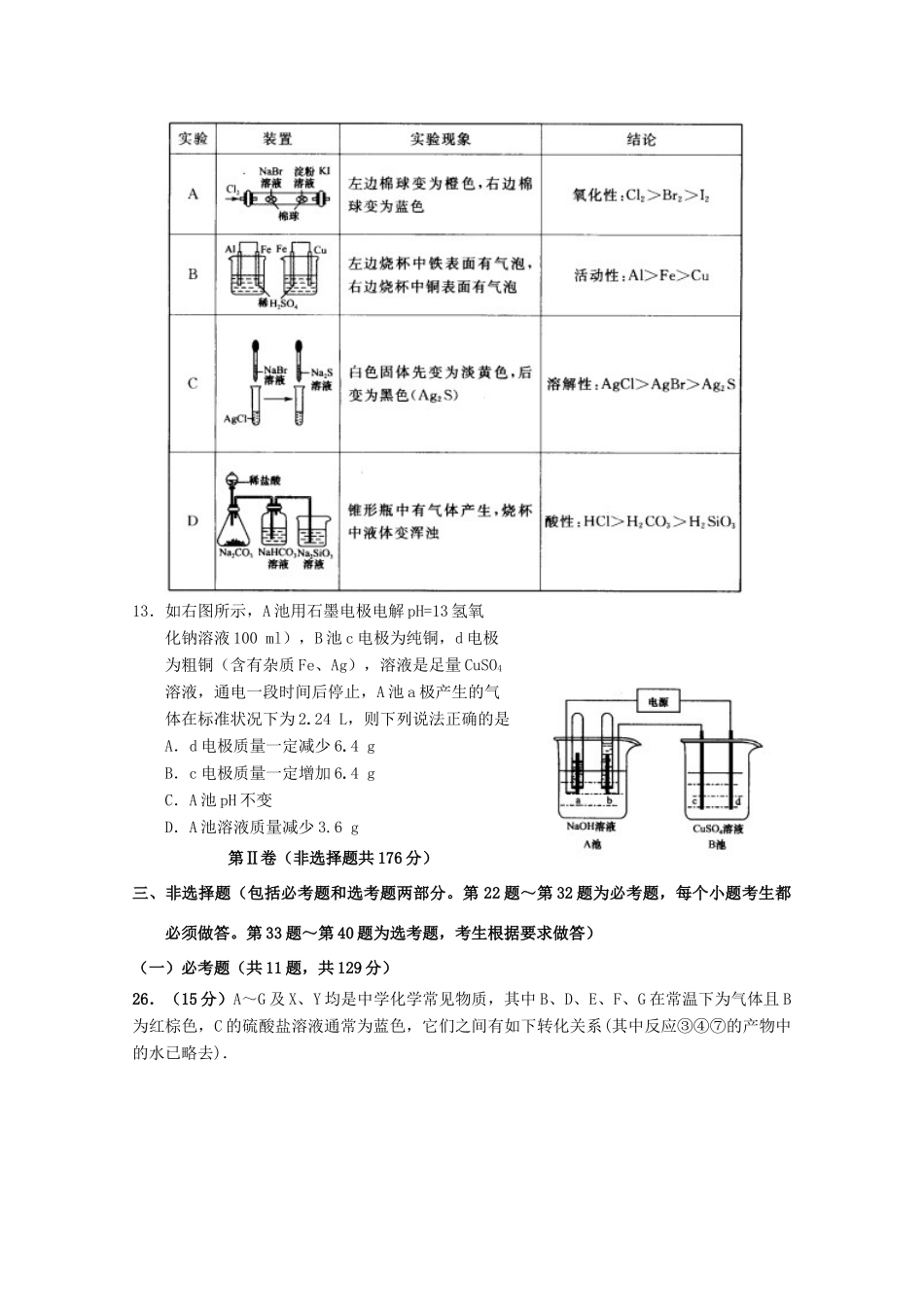
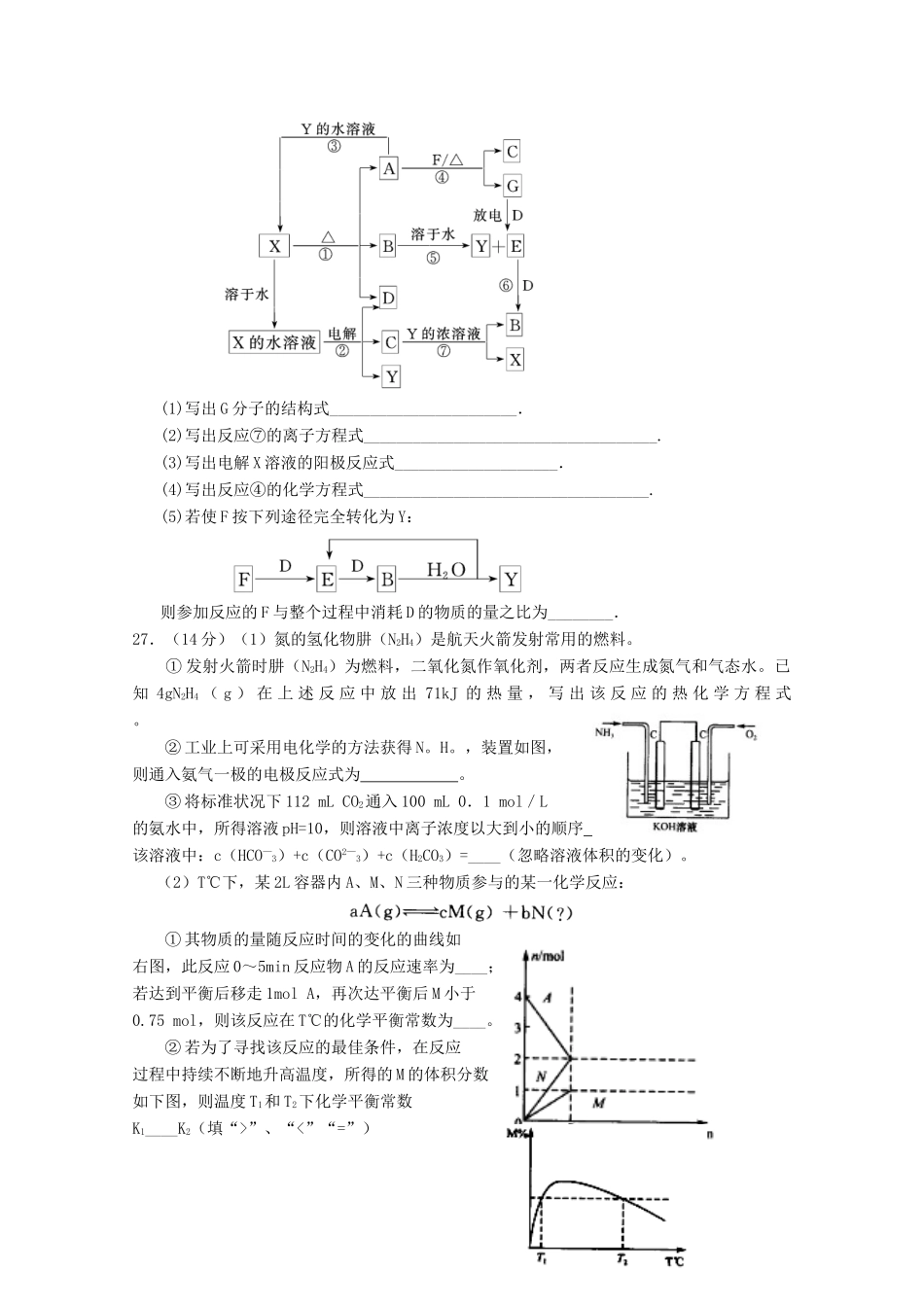
模拟复习检测试题16可能用到的相对分子质量:H1C12N14O16Na23Al27Cu641127第I卷(选择题共126分)本卷共21小题,每小题6分,共126分。一、选择题:(本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。)7.下列化学用语正确的是A.S2-的原子结构示意图为B.碳—12可表示为12CC.—OH的电子式为D.NaCl的分子式为NaCl8.下列关于有机物的说法中不正确的是A.正丁烷比异丁烷的沸点高B.乙烯、苯、乙烷分子中的所有原子都在同一平面上C.糖、油脂、蛋白质均是营养物质D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别9.下列对有机物结构或性质的描述,错误的是A.苯易发生取代反应,难发生加成反应B.光照下2,2—二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种C.乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2OD.乙酸能与金属钠反应,而乙醇不能与金属钠反应10.下列各组离子能大量共存的是①漂白粉的水溶液中:Fe2+、Cl-、Ca2+、Na+②滴加石蕊呈红色的溶液:K+、NH4+、Cl-、S2-③能够与金属Cu常温下反应放出气体的溶液;Fe3+、Al3+、SO42-、K+④pH=2的溶液中:NH4+、Na+、Cl-、Cu2+⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-A.②③B.①③C.③④D.①⑤11.X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是A.Y、Z的氧化物均是两性氧化物B.气态氢化物的稳定性:XWD.原子半径:W>Y>Z>X12.下列实验装置、现象、结论不正确的是13.如右图所示,A池用石墨电极电解pH=13氢氧化钠溶液100ml),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止,A池a极产生的气体在标准状况下为2.24L,则下列说法正确的是A.d电极质量一定减少6.4gB.c电极质量一定增加6.4gC.A池pH不变D.A池溶液质量减少3.6g第Ⅱ卷(非选择题共176分)三、非选择题(包括必考题和选考题两部分。第22题~第32题为必考题,每个小题考生都必须做答。第33题~第40题为选考题,考生根据要求做答)(一)必考题(共11题,共129分)26.(15分)A~G及X、Y均是中学化学常见物质,其中B、D、E、F、G在常温下为气体且B为红棕色,C的硫酸盐溶液通常为蓝色,它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去).(1)写出G分子的结构式_______________________.(2)写出反应⑦的离子方程式____________________________________.(3)写出电解X溶液的阳极反应式____________________.(4)写出反应④的化学方程式___________________________________.(5)若使F按下列途径完全转化为Y:则参加反应的F与整个过程中消耗D的物质的量之比为________.27.(14分)(1)氮的氢化物肼(N2H4)是航天火箭发射常用的燃料。①发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式。②工业上可采用电化学的方法获得N。H。,装置如图,则通入氨气一极的电极反应式为。③将标准状况下112mLCO2通入100mL0.1mol/L的氨水中,所得溶液pH=10,则溶液中离子浓度以大到小的顺序。该溶液中:c(HCO—3)+c(CO2—3)+c(H2CO3)=____(忽略溶液体积的变化)。(2)T℃下,某2L容器内A、M、N三种物质参与的某一化学反应:①其物质的量随反应时间的变化的曲线如右图,此反应0~5min反应物A的反应速率为____;若达到平衡后移走1molA,再次达平衡后M小于0.75mol,则该反应在T℃的化学平衡常数为____。②若为了寻找该反应的最佳条件,在反应过程中持续不断地升高温度,所得的M的体积分数如下图,则温度T1和T2下化学平衡常数K1____K2(填“>”、“<”“=”)36.(15分)NaCl是价廉且应用广泛的化工业原料,例如,纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,...