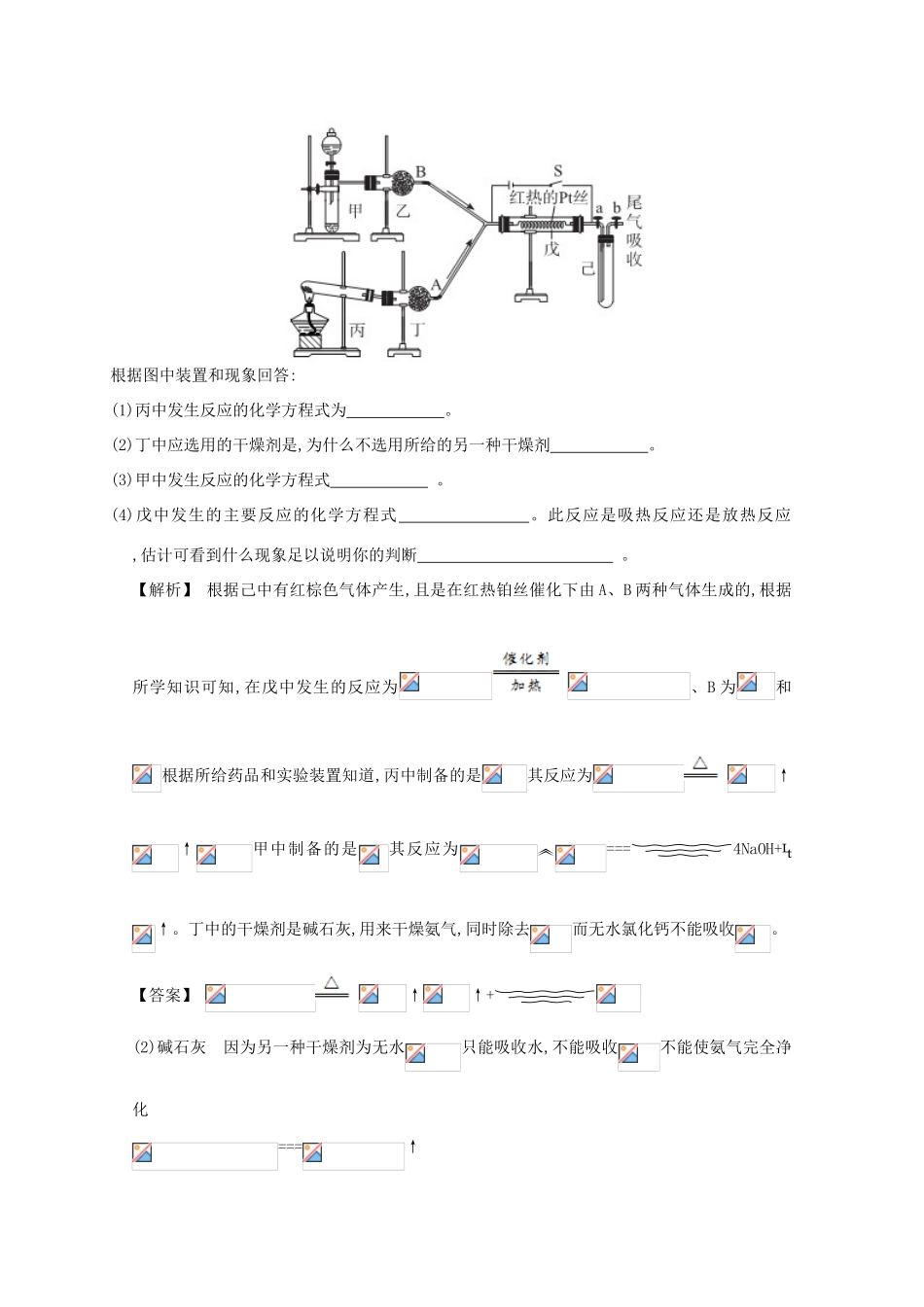
综合实验评价03三、非选择题(本题包括4小题,共50分)11.(10分)某化学小组利用下图装置完成和CO的反应。(1)实验开始前,首先必须进行的操作为。实验开始时,通入CO气体和加热的先后顺序为,点燃酒精灯之前,必须检验从装置中排出的CO的纯度。实验过程中,判断反应发生的现象为。(2)实验时可在酒精灯火焰上罩一个金属网罩,该金属网罩的作用是。酒精灯对加热温度可达到500------600℃,若要提高反应温度,还可选用的加热仪器为。(3)查阅资料知和CO加热进行反应,固体质量与反应温度的关系如下图所示。则500-----600℃时的还原产物是。请设计一个简单的实验,证明650700℃时的还原产物,简述实验操作和现象。可供选择的试剂:稀硫酸、稀盐酸、溶液、NaOH溶液、KSCN溶液。【解析】(1)一般来说,凡涉及气体,特别是有毒气体的组装实验装置,实验前都需要检验装置气密性,而对含可燃性气体的装置加热时,要确保加热时可燃性气体中不含有空气,以防爆炸。(2)金属网罩可以使火力更加集中,提高加热温度。(3)CO还原的还原产物可能为、根据图中质量变化可知500----600℃的还原产物为Fe---700℃的还原产物为FeO,而800℃以后的还原产物为Fe。要检验FeO,可以利用不能与KSCN溶液显色,而被氧化后生成的可与KSCN溶液显色的性质,也可以利用能使溶液褪色的性质。【答案】(1)检查装置的气密性先通入CO一段时间,后加热红棕色粉末逐渐变黑,澄清石灰水变浑浊(2)提高反应温度,确保受热均匀酒精喷灯在适量待检物中加入稀硫酸至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去(其他合理答案也可)12.(10分)实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:、、、、NaCl、无水、、碱石灰等固体和蒸馏水。根据图中装置和现象回答:(1)丙中发生反应的化学方程式为。(2)丁中应选用的干燥剂是,为什么不选用所给的另一种干燥剂。(3)甲中发生反应的化学方程式。(4)戊中发生的主要反应的化学方程式。此反应是吸热反应还是放热反应,估计可看到什么现象足以说明你的判断。【解析】根据己中有红棕色气体产生,且是在红热铂丝催化下由A、B两种气体生成的,根据所学知识可知,在戊中发生的反应为、B为和根据所给药品和实验装置知道,丙中制备的是其反应为↑↑甲中制备的是其反应为===4NaOH+↑。丁中的干燥剂是碱石灰,用来干燥氨气,同时除去而无水氯化钙不能吸收。【答案】↑↑+(2)碱石灰因为另一种干燥剂为无水只能吸收水,不能吸收不能使氨气完全净化===↑放热可以看到戊中铂丝比开始反应时更加红热13.(15分)溴被称为”海洋元素”。已知的沸点为59℃,微溶于水,有毒性和强腐蚀性。实验室模拟从海水中提取溴的主要步骤为:步骤1:将海水蒸发浓缩除去粗盐;步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使转化为;步骤3:向步骤2所得的水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中;步骤4:再向该容器中通入适量的氯气,使转化为;步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴。(1)步骤3中热空气或水蒸气能将溴单质吹出的原因是。(2)步骤3中反应的离子方程式。(3)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是。(4)步骤5中萃取和分液所需要的主要玻璃仪器为。(5)用下图实验装置可精制粗溴。①反应过程中需要对A容器加热,加热的方法是。图中冷却水应从B的口进入(填”a”或”b”)。②C中加冰的目的是。D装置的作用是。【解析】溴是易挥发的液体,所以要让溴挥发,需具备一定的浓度和一定的温度。粗盐水中的浓度小,生成的浓度也小,所以应先富集,后提取。【答案】(1)溴单质的沸点低,易挥发===(3)步骤2氯化后,虽然含有溴单质,但浓度低,通过步骤3和4富集(浓缩)溴元素(或只回答富集溴元素也对)(4)分液漏斗(5)①水浴加热b②降温,减少溴的挥发吸收尾气14.(15分)可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0---50mL),乙管可上下移动...