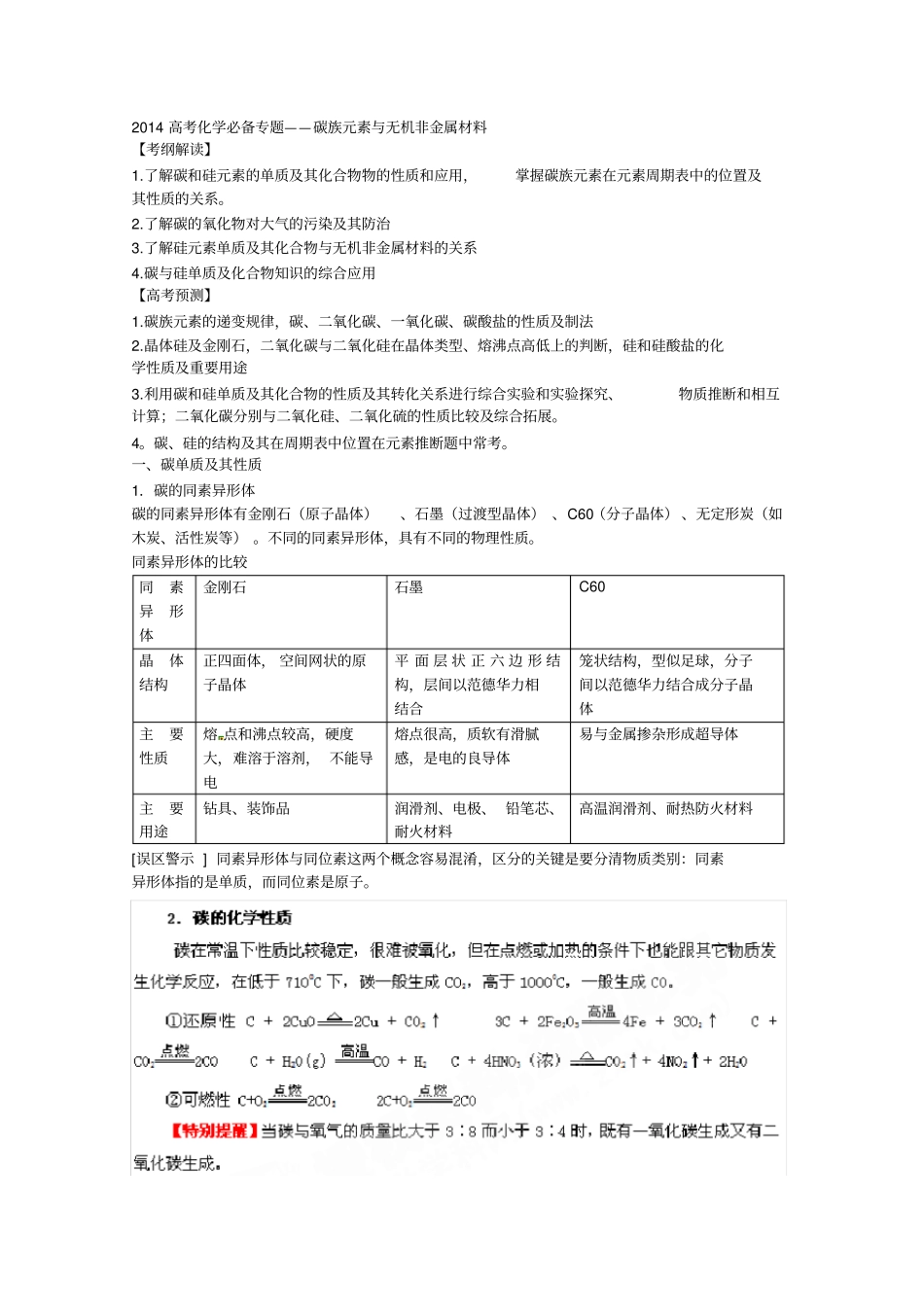
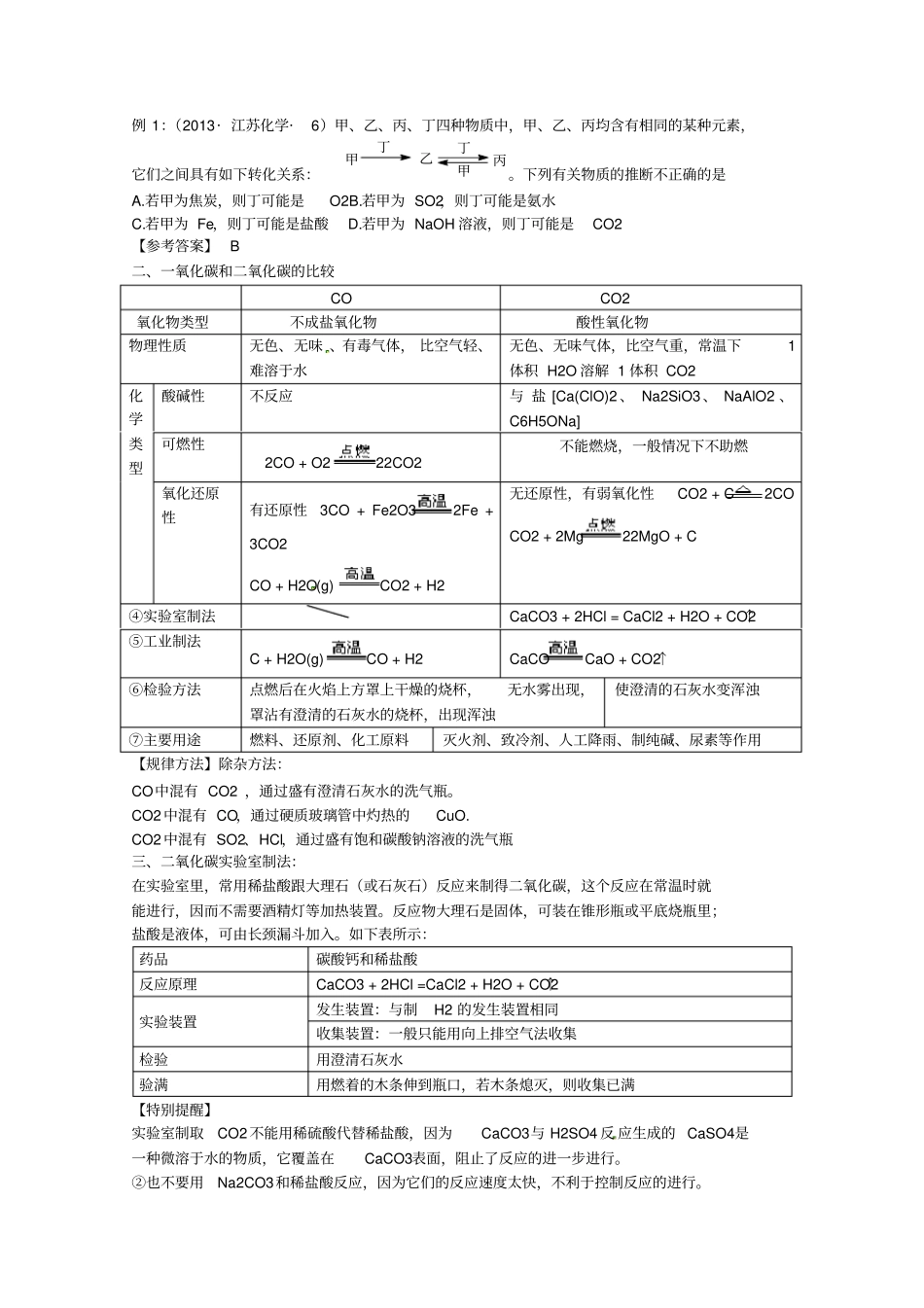
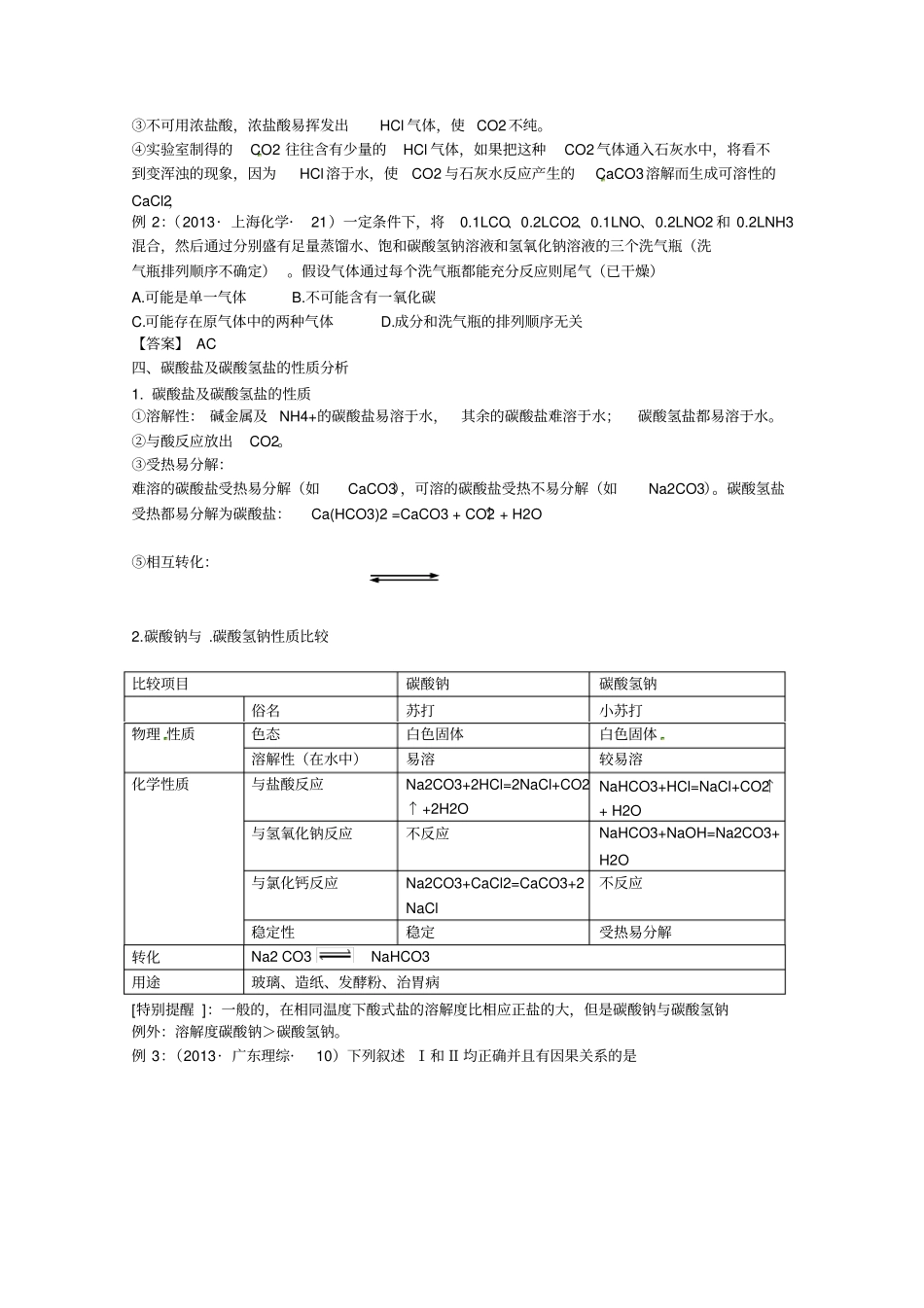
2014高考化学必备专题——碳族元素与无机非金属材料【考纲解读】1.了解碳和硅元素的单质及其化合物物的性质和应用,掌握碳族元素在元素周期表中的位置及其性质的关系。2.了解碳的氧化物对大气的污染及其防治3.了解硅元素单质及其化合物与无机非金属材料的关系4.碳与硅单质及化合物知识的综合应用【高考预测】1.碳族元素的递变规律,碳、二氧化碳、一氧化碳、碳酸盐的性质及制法2.晶体硅及金刚石,二氧化碳与二氧化硅在晶体类型、熔沸点高低上的判断,硅和硅酸盐的化学性质及重要用途3.利用碳和硅单质及其化合物的性质及其转化关系进行综合实验和实验探究、物质推断和相互计算;二氧化碳分别与二氧化硅、二氧化硫的性质比较及综合拓展。4。碳、硅的结构及其在周期表中位置在元素推断题中常考。一、碳单质及其性质1.碳的同素异形体碳的同素异形体有金刚石(原子晶体)、石墨(过渡型晶体)、C60(分子晶体)、无定形炭(如木炭、活性炭等)。不同的同素异形体,具有不同的物理性质。同素异形体的比较同素异形体金刚石石墨C60晶体结构正四面体,空间网状的原子晶体平面层状正六边形结构,层间以范德华力相结合笼状结构,型似足球,分子间以范德华力结合成分子晶体主要性质熔点和沸点较高,硬度大,难溶于溶剂,不能导电熔点很高,质软有滑腻感,是电的良导体易与金属掺杂形成超导体主要用途钻具、装饰品润滑剂、电极、铅笔芯、耐火材料高温润滑剂、耐热防火材料[误区警示]同素异形体与同位素这两个概念容易混淆,区分的关键是要分清物质类别:同素异形体指的是单质,而同位素是原子。例1:(2013·江苏化学·6)甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲丁乙丙丁甲。下列有关物质的推断不正确的是A.若甲为焦炭,则丁可能是O2B.若甲为SO2,则丁可能是氨水C.若甲为Fe,则丁可能是盐酸D.若甲为NaOH溶液,则丁可能是CO2【参考答案】B二、一氧化碳和二氧化碳的比较COCO2氧化物类型不成盐氧化物酸性氧化物物理性质无色、无味、有毒气体,比空气轻、难溶于水无色、无味气体,比空气重,常温下1体积H2O溶解1体积CO2化学类型酸碱性不反应与盐[Ca(ClO)2、Na2SiO3、NaAlO2、C6H5ONa]可燃性2CO+O222CO2不能燃烧,一般情况下不助燃氧化还原性有还原性3CO+Fe2O32Fe+3CO2CO+H2O(g)CO2+H2无还原性,有弱氧化性CO2+C2COCO2+2Mg22MgO+C④实验室制法CaCO3+2HCl=CaCl2+H2O+CO2↑⑤工业制法C+H2O(g)CO+H2CaCOCaO+CO2↑⑥检验方法点燃后在火焰上方罩上干燥的烧杯,无水雾出现,罩沾有澄清的石灰水的烧杯,出现浑浊使澄清的石灰水变浑浊⑦主要用途燃料、还原剂、化工原料灭火剂、致冷剂、人工降雨、制纯碱、尿素等作用【规律方法】除杂方法:CO中混有CO2,通过盛有澄清石灰水的洗气瓶。CO2中混有CO,通过硬质玻璃管中灼热的CuO.CO2中混有SO2、HCl,通过盛有饱和碳酸钠溶液的洗气瓶三、二氧化碳实验室制法:在实验室里,常用稀盐酸跟大理石(或石灰石)反应来制得二氧化碳,这个反应在常温时就能进行,因而不需要酒精灯等加热装置。反应物大理石是固体,可装在锥形瓶或平底烧瓶里;盐酸是液体,可由长颈漏斗加入。如下表所示:药品碳酸钙和稀盐酸反应原理CaCO3+2HCl=CaCl2+H2O+CO2↑实验装置发生装置:与制H2的发生装置相同收集装置:一般只能用向上排空气法收集检验用澄清石灰水验满用燃着的木条伸到瓶口,若木条熄灭,则收集已满【特别提醒】实验室制取CO2不能用稀硫酸代替稀盐酸,因为CaCO3与H2SO4反应生成的CaSO4是一种微溶于水的物质,它覆盖在CaCO3表面,阻止了反应的进一步进行。②也不要用Na2CO3和稀盐酸反应,因为它们的反应速度太快,不利于控制反应的进行。③不可用浓盐酸,浓盐酸易挥发出HCl气体,使CO2不纯。④实验室制得的CO2往往含有少量的HCl气体,如果把这种CO2气体通入石灰水中,将看不到变浑浊的现象,因为HCl溶于水,使CO2与石灰水反应产生的CaCO3溶解而生成可溶性的CaCl2,例2:(2013·上海化学·21)一定条件下,将0.1LCO、0.2LCO2、0.1LNO、0.2LNO2和0.2LNH3混合,然后通过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个...