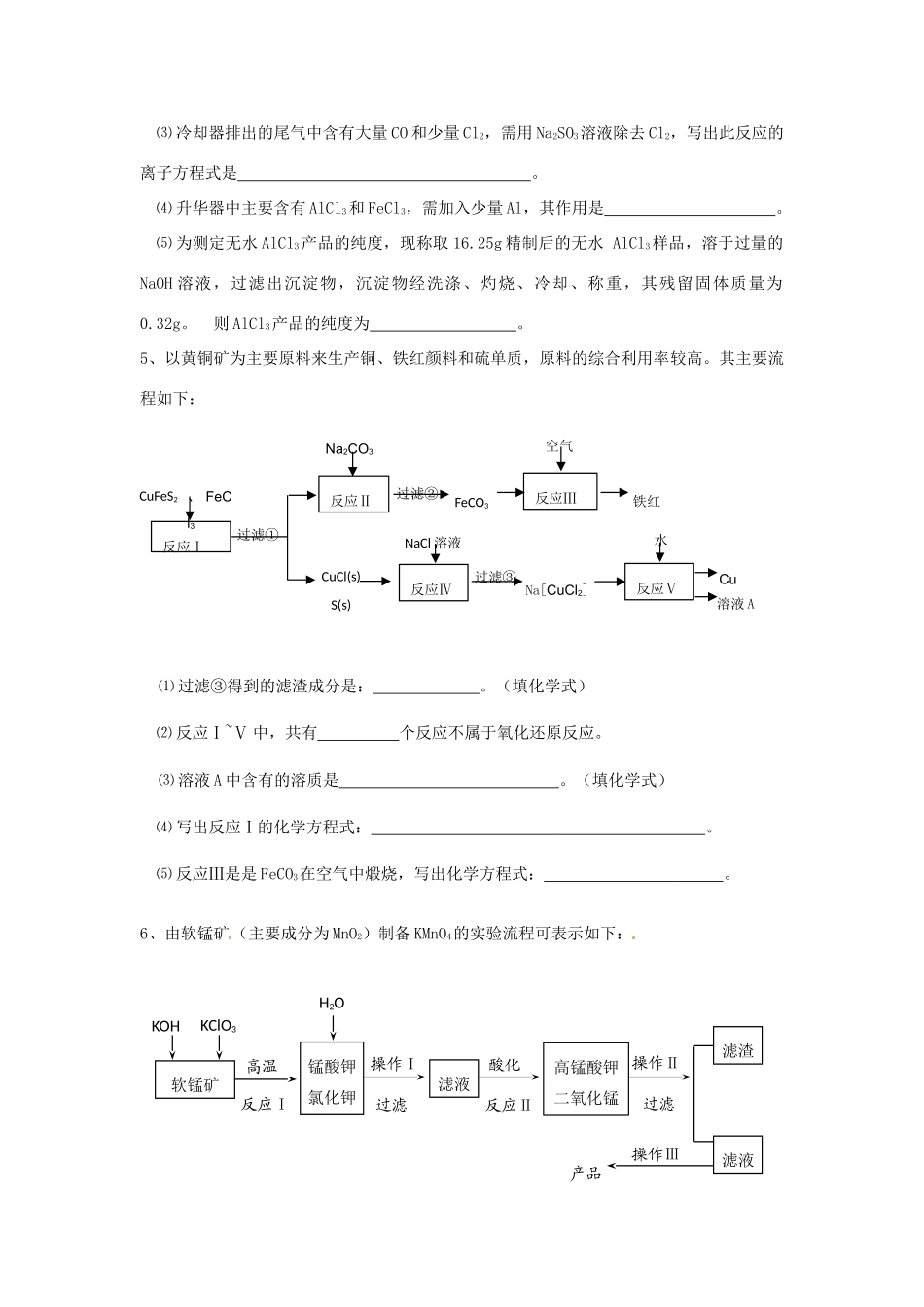
怀仁中学高三化学复习《流程图》练习(4)1、菱锰矿的主要成分是碳酸锰,还含Fe2O3、FeO、CaO、MgO等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnC12·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水),部分工艺流程如下:(1)废盐酸与菱锰矿中碳酸锰反应的化学方程式为。(2)酸浸时,浸出时间对锰浸出率的影响如右图所示,工业采用的是浸取60min,其可能原因是。(3)图中“净化剂X”可能是。(4)过滤4获得的盐Y,其主要成分是。(5)浓缩结晶时,必须一出现晶膜就立刻停止加热,其原因是。2、烧结法制氧化铝生产过程如下:已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。②高温烧结时Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。请回答下列问题:(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式。(2)浸出时再加入CaO的目的是。(3)浸出液中发生的生成Al(OH)3的离子反应方程式。(4)滤液的主要成分是(写化学式);滤液循环使用的优点。(任答一点)3、照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。(已知:4H++2[Ag(S2O3)2]3-=Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)⑴操作Ⅲ的名称是;操作Ⅱ需要的主要玻璃仪器有。⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为。⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是。⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是。⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为。4、无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。⑴AlCl3是晶体。⑵氯化炉中Al2O3、C12和C反应的化学方程式是。焙烧炉(800)℃氯化炉(950)℃冷却器升华器无水AlCl3铝土矿石油焦NaCl固体Cl2、AlO2石油焦CO、Cl2⑶冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,写出此反应的离子方程式是。⑷升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是。⑸为测定无水AlCl3产品的纯度,现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.32g。则AlCl3产品的纯度为。5、以黄铜矿为主要原料来生产铜、铁红颜料和硫单质,原料的综合利用率较高。其主要流程如下:⑴过滤③得到的滤渣成分是:。(填化学式)⑵反应Ⅰ~Ⅴ中,共有个反应不属于氧化还原反应。⑶溶液A中含有的溶质是。(填化学式)⑷写出反应Ⅰ的化学方程式:。⑸反应Ⅲ是是FeCO3在空气中煅烧,写出化学方程式:。6、由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:CuFeS2反应ⅣNaCl溶液CuCl(s)S(s)铁红反应ⅢFeCO3过滤②Na2CO3反应Ⅱ过滤①、FeCl3反应ⅠCu过滤③Na[CuCl2]反应Ⅴ空气水溶液A软锰矿锰酸钾氯化钾高温滤液KOHKClO3反应ⅠH2O操作Ⅰ过滤酸化反应Ⅱ高锰酸钾二氧化锰操作Ⅱ过滤滤液操作Ⅲ滤渣产品试回答下列问题:(1)反应Ⅰ发生反应的化学方程式是;反应Ⅱ发生反应的离子方程式是;(2)操作Ⅲ的实验步骤为、;可循环利用的物质的化学式为;(3)计算用2.5kg含MnO280%的软锰矿制备,理论上可得KMnO4为:(4)取制得的产品6.5g,配成250mL溶液;准确称取纯Na2C2O41.34g配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。计算该KMnO4的纯度。7、白炭黑(SiO2·H2O)广泛用于橡胶、涂料、印刷等行业,可用蛇纹石[主要成分为Mg(SiO10)(OH)3]来制取,其主要工艺流程如下:(1)蛇纹石用氧化物形式可表示为。(2)碱浸时,为提高其中硅酸盐的浸取率,除采用合适的液固比和循环浸取外,还可采用的方法有①;②(任举两种)。(3)过滤1得到的滤液的主要成分是。(4)沉淀时加入氯化钠溶液...