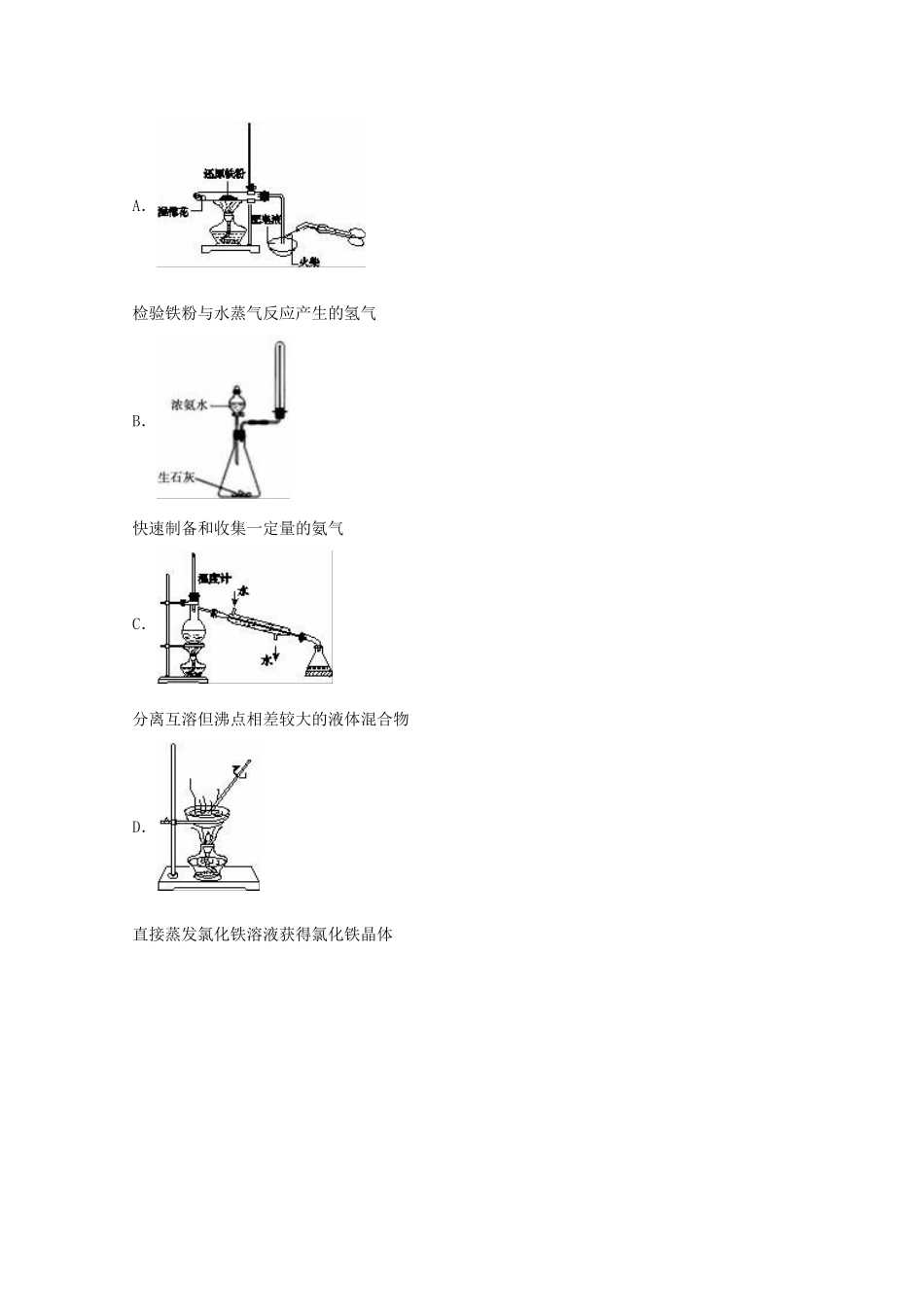
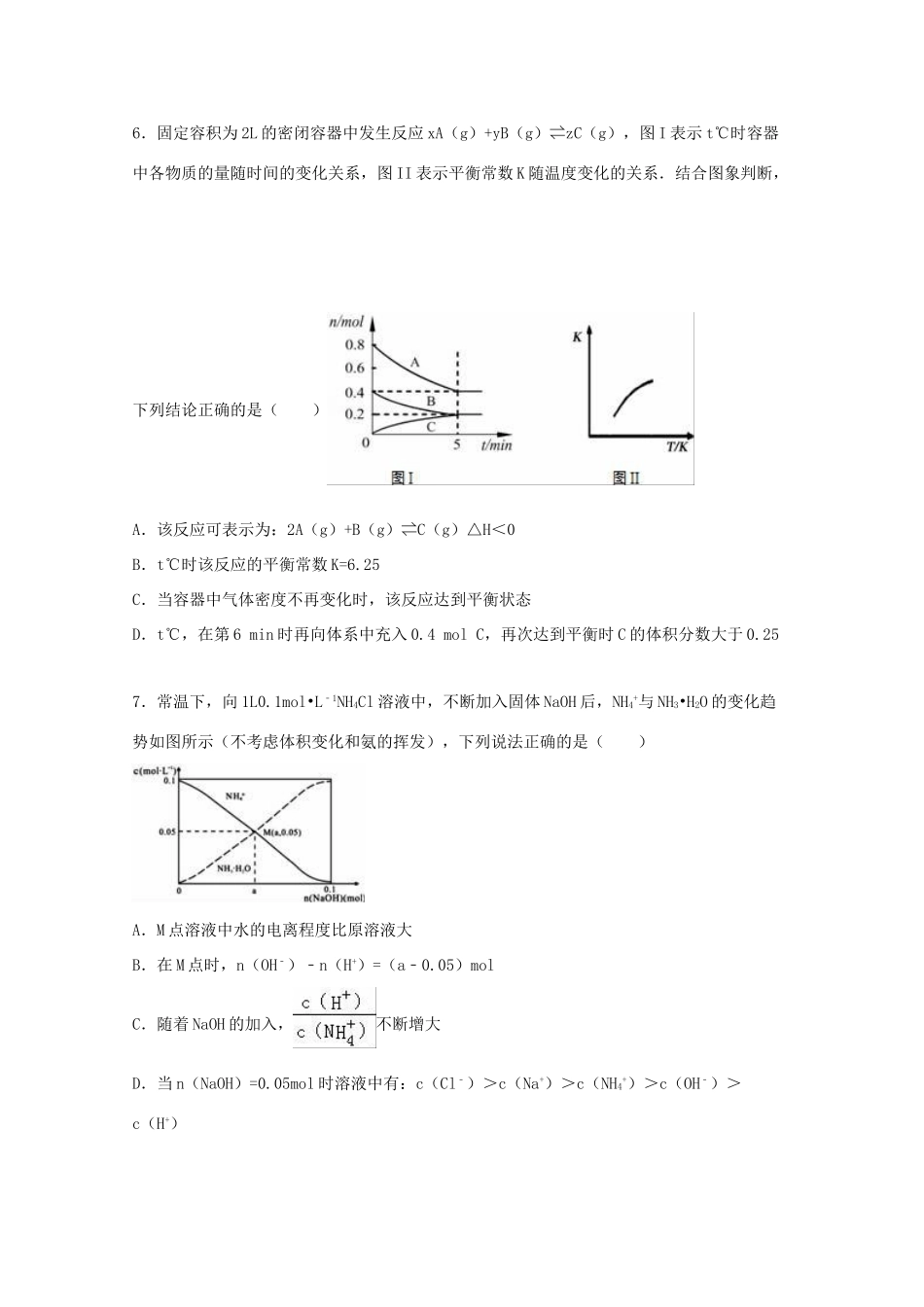
2016年四川省遂宁市高考化学二诊试卷一、选择题(本大题共7小题,每小题6分,共42分.在每小题给出的四个选项中,只有一项符合题目要求)1.化学与生活和工农业生产密切相关,下列说法不正确的是()A.Fe2O3俗称铁红,常用作红色油漆和涂料B.二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等,还可用于杀菌消毒C.废旧钢材焊接前,分别用饱和Na2CO3,NH4Cl溶液处理焊点D.聚丙烯酸钠树脂广泛应用于植物移栽及制作尿不湿2.设NA为阿伏加德罗常数的值,下列说法正确的是()A.1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为2NAB.1LpH=2的NaHSO3溶液中,由水电离的H+数目为0.01NA个C.1.5gCH3+里含有的电子数目为NAD.62g白磷中含有P_P键的数目为3NA3.下列有关0.1mol/LNa2S溶液的叙述正确的是()A.该溶液中存在两个平衡、七种粒子B.该溶液中K+、NH4+、NO3﹣、Al3+可以大量共存C.滴加少量稀硫酸,充分振荡无现象D.通入足量SO2气体,发生反应的离子方程式:2S2﹣+SO2+2H2O═3S↓+4OH﹣4.X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z3种元素形成化合物乙.下列说法错误的是()A.气体甲可与Z的某种氢化物反应生成强酸B.化合物乙中一定只有共价键C.W元素的某种单质可在电子工业用于生产半导体材料D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM5.下列操作或装置能达到实验目的是()A.检验铁粉与水蒸气反应产生的氢气B.快速制备和收集一定量的氨气C.分离互溶但沸点相差较大的液体混合物D.直接蒸发氯化铁溶液获得氯化铁晶体6.固定容积为2L的密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是()A.该反应可表示为:2A(g)+B(g)⇌C(g)△H<0B.t℃时该反应的平衡常数K=6.25C.当容器中气体密度不再变化时,该反应达到平衡状态D.t℃,在第6min时再向体系中充入0.4molC,再次达到平衡时C的体积分数大于0.257.常温下,向1L0.1mol•L﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是()A.M点溶液中水的电离程度比原溶液大B.在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)molC.随着NaOH的加入,不断增大D.当n(NaOH)=0.05mol时溶液中有:c(Cl﹣)>c(Na+)>c(NH4+)>c(OH﹣)>c(H+)二、解答题(共4小题,满分58分)8.已知A、B、C、D四种短周期元素的核电荷数依次增大.A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族.E、F是第四周期元素,且E位于周期表中ds区,F原子核外有33种不同运动状态的电子.根据以上信息用相应的元素符号填空:(1)E+核外电子排布式为,FC43﹣离子的空间构型为,与其互为等电子体的一种有机分子为(填化学式).(2)B元素所在周期第一电离能最大的元素是(填元素符号).(3)D所在周期元素最高价氧化物对应的水化物中,酸性最强的是(填化学式);能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是(填化学式).(4)已知EDC4溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图所示:①配合物A中碳原子的轨道杂化类型为.②1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为.(5)化合物F2C3常用于标定未知浓度的酸性KMnO4溶液,反应生成F的最高价含氧酸,该反应的离子方程式是.9.氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性.NCl3的相关性质如下:物理性质制备原理化学性质黄色油状液体,熔点为﹣40℃,沸点为71℃,不溶于冷Cl2与NH4Cl水溶液95℃爆炸,热水水,易溶于有机溶剂,密度为1....